Tabla de Contenidos
¿Qué es la Ley de Boyle?
La Ley de Boyle es una ley de proporcionalidad que describe la relación entre la presión y el volumen cuando una cantidad fija de un gas ideal es sometida a cambios de estado manteniendo la temperatura constante. Según esta ley, cuando se mantienen constantes la temperatura y la cantidad del gas, la presión y el volumen son inversamente proporcionales. Esto significa que cuando una de las dos variables aumenta, la otra disminuye, y viceversa.
La fórmula de la Ley de Boyle
Matemáticamente, la Ley de Boyle se expresa como una relación de proporcionalidad de la que se deducen una serie de fórmulas de gran utilidad para predecir el efecto de los cambios de presión sobre el volumen o de los cambios de volumen sobre la presión.
Según la ley de Boyle, cuando se mantiene la temperatura constante, la presión es inversamente proporcional al volumen o, lo que es lo mismo, es proporcional al inverso del volumen. Esto se expresa de la siguiente forma:
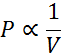
Esta relación de proporcionalidad se puede reescribir en forma de una ecuación al agregar una constante de proporcionalidad, k:
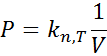

Aquí, los subíndices n y T resaltan el hecho de que la constante k solo es constante siempre y cuando la cantidad del gas (el número de moles) y la temperatura permanezcan constantes. Esta relación tiene una implicación muy sencilla: si el producto de P.V permanece constante siempre que n y T también permanezcan constantes, entonces el estado inicial y final de una transformación que ocurra a temperatura constante estarán relacionados por la siguiente ecuación:
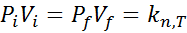
De donde se desprende que:

Esta es la fórmula general de la ley de Boyle. Dicha fórmula se puede utilizar para determinar cualquiera de las cuatro variables del estado de un gas, siempre que se conozcan las otras tres. En otras palabras, la ley de Boyle permite determinar la presión o el volumen, bien sea del estado inicial o final de un gas ideal que sufre un cambio de estado a n y T constantes, siempre que se conozcan las otras tres variables.
Veamos ahora algunos ejemplos de cómo se utiliza esta ecuación para resolver problemas de gases ideales.
Ejemplos del uso de la fórmula de Boyle para gases ideales
Ejemplo 1
Se tienen dos balones, uno de 2,00 L y otro de 6,00 L conectados por medio de un acople con una llave de paso. En el balón de 2,00 L se introduce dióxido de carbono a una presión inicial de 5,00 atm, mientras que el balón de 6 L es evacuado (está ahora vacío). ¿Cuál será la presión final del dióxido de carbono en el sistema, una vez se abra la llave de paso?
Solución
En problemas como estos, resulta de gran utilidad, en primer lugar, dibujar un esquema del planteamiento del problema y, en segundo lugar, anotar todos los datos e incógnitas que proporciona el enunciado.
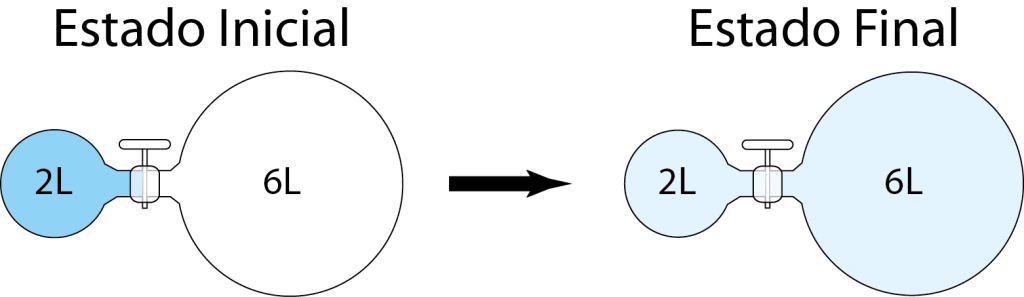
Como se puede ver, al principio, todo el dióxido de carbono (CO2) se encuentra confinado al primer balón de la izquierda, así que su volumen inicial es de 2,00 L y la presión inicial es de 5,00 atm. Luego, al abrir la llave de paso, el gas se expandirá hasta ocupar ambos balones, así que el volumen final será de 2,00 L + 6,00 L= 8,00 L, pero la presión final es desconocida. Así que:


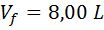

Ahora, el siguiente paso es utilizar la fórmula de Boyle para determinar la presión final. Como ya conocemos todas las demás variables, lo único que hace falta es resolver la ecuación para Pf:

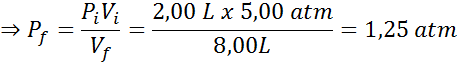
Por lo tanto, la presión final, luego de abrir la llave de paso se reducirá a 1,25 atm.
Ejemplo 2
¿En qué proporción aumentará el volumen de una pequeña burbuja de aire formada en el fondo de una piscina de 20,0 m de profundidad si sube hasta la superficie, donde la presión atmosférica es de 1,00 atm? Asuma que la cantidad de aire no cambia y que la temperatura cerca de la superficie es la misma que en el fono de la piscina. Finalmente, el agua pura ejerce una presión hidrostática de aproximadamente 1 atm por cada 10 metros de profundidad.
Solución
En este caso, nuevamente tenemos un gas que va a sufrir un cambio de estado al pasar desde el fondo de la piscina hasta la superficie. Además, este cambio va a ocurrir a temperatura constante y a cantidad del gas constante, en base al enunciado. Bajo estas condiciones, se puede utilizar la fórmula de la Ley de Boyle
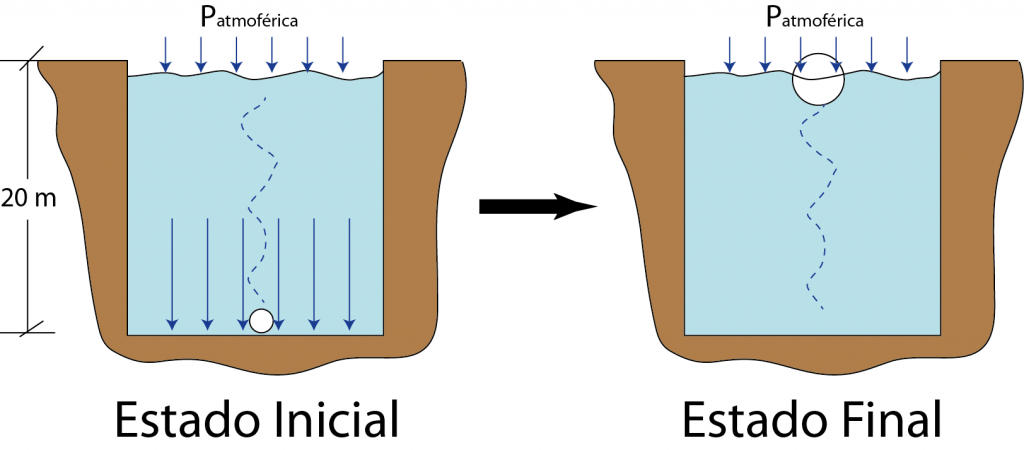
El asunto en este caso es que no se conoce ni la presión inicial, ni ninguno de los dos volúmenes. La presión final es de 1,00 atm ya que la burbuja llega a la superficie del agua, dónde la única presión es la atmosférica.
Para determinar la presión inicial (cuando la burbuja está en el fondo de la piscina), basta con sumar la contribución de la atmósfera, con la contribución de la presión hidrostática de la columna de agua que tiene por encima. Como la profundidad es de 20 m, y por cada 10 m la presión aumenta en 1 atm, entonces la nueva presión total al llegar la burbuja a la superficie es:
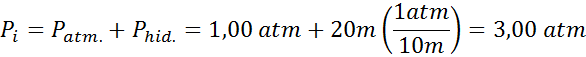
Como lo que se quiere determinar es la proporción en la que aumenta el volumen y no el volumen en sí de la burbuja, entonces se está buscando la relación Vf/Vi, la cual se puede hallar de la fórmula de Boyle:
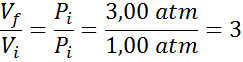
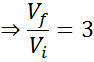
Como se puede ver, a pesar de que no conocemos ninguno de los dos volúmenes, se pude determinar que el volumen final de la burbuja es tres veces mayor que el inicial.
Referencias
Chang, R., & Goldsby, K. A. (2012). Chemistry, 11th Edition (11th ed.). New York City, New York: McGraw-Hill Education.



