Tabla de Contenidos
La masa atómica y el número de masa o número másico son dos conceptos que se confunden con frecuencia. La razón detrás de la confusión es que, para la mayoría de los elementos, los valores de la masa atómica y del número de masa son muy similares, en especial si la masa atómica se redondea a un número entero. Sin embargo, ambos términos representan conceptos diferentes relacionados con los átomos.
Comencemos con definir cada uno por separado para luego explicar las diferencias.
¿Qué es la masa atómica?
Tal como su nombre indica, la masa atómica representa la masa de un solo átomo de determinado elemento químico. En otras palabras, representa la cantidad de materia que contiene un átomo.
Cada átomo posee una masa atómica característica que proviene de la suma de las masas de todas las partículas subatómicas que lo componen, tal como los protones, los neutrones y los electrones. Esta masa es exactamente igual para todos los átomos de un isótopo particular de determinado elemento químico.
Por ejemplo, todos los átomos del isótopo 12 del carbono tienen una masa atómica de 12 uma y todos los átomos del isótopo 13 del carbono tienen una masa atómica de 13,00335 uma.
¿Qué es el número de masa?
El número de masa de un átomo corresponde al número total de nucleones que contiene en su núcleo. En otras palabras, es la suma de su número de protones y neutrones y se suele representar con la letra A.
El número de protones determina las propiedades químicas de un átomo. Éste número determina de qué tipo de átomo se trata (hidrógeno, helio, oxígeno, etc.) por lo que se le denomina número atómico, y se representa con la letra Z.
Por otro lado, el número de neutrones en el núcleo de un átomo se representa con la letra n. De esta manera, podemos escribir la siguiente ecuación para el número de masa:
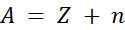
Ejemplo
Supongamos que se pide determinar del número atómico de un átomo de litio que contiene 4 neutrones en su núcleo.
Solución:
Z = 3 (porque 3 es el número atómico del litio)
n = 4 (porque tiene 4 neutrones), así que
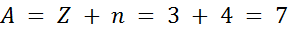
Por lo que el número de masa de este átomo de litio será 7.
Diferencias entre masa atómica y número de masa
| Masa Atómica o Peso Atómico | Número de Masa (A) | |
| Concepto | La masa atómica representa la masa de un solo átomo. | El número de masa representa el número total de protones y neutrones en el núcleo de un átomo. |
| Unidades | Unidades de masa tales como: Unidades de masa atómica (uma), kilogramos, libras, etc. | Cantidad adimensional (es un número puro, sin unidades) |
| Tipo de número | Número decimal determinado experimentalmente. | Número entero determinado sumando el número atómico con el número de neutrones en el núcleo de un átomo. |
| Variación en el tiempo | Al ser determinada experimentalmente, las masas atómicas suelen cambiar con el tiempo a medida que los científicos obtienen mediciones más precisas o se obtienen datos nuevos de abundancias isotópicas. | No cambian en el tiempo ya que los átomos solo pueden tener un número entero de protones y neutrones. Una vez determinados dichos números, estos no cambian. |
| Usos | Se utiliza principalmente en cálculos estequiométricos. | Se utiliza principalmente para identificar los distintos isótopos de un elemento. |
| Representación | Se suele representar con el símbolo MA o PA con el símbolo del elemento como subíndice. Ejemplo: PAFe representa el peso atómico del átomo de hierro. | Se representa de dos formas: 1.- Como exponente a la izquierda del símbolo químico del elemento. Ejemplo: 14C. 2.- Como un número a la derecha del símbolo químico precedido de un guion. Ejemplo: C-14 |
Ejemplos para ilustrar la diferencia entre número atómico y masa atómica
Cada elemento posee una serie de isótopos que se encuentran mezclados entre sí de forma natural en todas las muestras de dicho elemento. Por ejemplo, si tomamos una muestra de, digamos, 1 gramo de carbono, entre los millones y millones de átomos presentes habrá por lo menos 4 isótopos diferentes. Cada átomo de cada isótopo tendrá su propia masa atómica y su propio número atómico, los cuales serán diferentes entre sí, como se puede observar en la siguiente tabla.
| Z | n | A | Masa Atómica | Abundancia (%) | |
| Carbono-11 | 6 | 5 | 11 | 11.0114336 uma | Trazas |
| Carbono-12 | 6 | 6 | 12 | 12 uma | »98,9 |
| Carbono-13 | 6 | 7 | 13 | 13.0033548 uma | »1,1 |
| Carbono-14 | 6 | 8 | 14 | 14.0032420 uma | Trazas |
Como se puede ver en la tabla, todos los isótopos poseen el mismo número atómico (6) ya que todos son átomos del mismo elemento, es decir, carbono. Sin embargo, tienen diferentes números de neutrones, número de masa y masa atómica.
La excepción a la regla
El caso del isótopo 12 del carbono es una excepción a la regla de que el número atómico y la masa atómica son cantidades siempre diferentes. De hecho, como se pudo ver en la tabla anterior, ambos valen exactamente 12.
Esto se debe a que la escala de las masas atómicas se definió desde hace años en función de la masa atómica del carbono-12, al cual se le asignó un valor de 12 unidades de masa atómica. Todas las demás masas atómicas se midieron en relación a esta masa. En otras palabras, la masa del carbono-12 es la única de todas las masas atómicas que no es determinada experimentalmente, sino que se estableció por definición.
Comentario final acerca de la masa atómica
Otro término relacionado que también se confunde tanto con la masa atómica como con el número atómico es la masa atómica promedio de un elemento. De hecho, cuando la inmensa mayoría de las personas (químicos incluidos) hablan de masa atómica, realmente se están refiriendo a la masa atómica promedio. Esta masa es la que realmente encontramos en la tabla periódica y representa el promedio de las masas de todos los isótopos naturales de determinado elemento.



