Tabla de Contenidos
Las fuerzas de dispersión de London son un tipo particular de fuerzas intermoleculares débiles de van der Waals. De hecho, representan las interacciones intermoleculares más débiles de todas. Son la clase de fuerzas de atracción de corto alcance que surgen entre cualquier par de moléculas o átomos cuando estos están muy cerca los unos de los otros. Este tipo de interacciones se forman por la presencia de dipolos instantáneos en la superficie de las moléculas que atraen a otros dipolos instantáneos en moléculas vecinas.
Al ser fuerzas tan débiles, son difíciles de medir u observar en compuestos iónicos y en moléculas polares, ya que estas presentan otros tipos de interacciones más fuertes que las enmascaran. Es por esto que las fuerzas de London solo se manifiestan de forma medible en las moléculas apolares y en las especies monoatómicas como los gases nobles.
De hecho, las fuerzas de dispersión de London son el único tipo de interacciones intermoleculares (o interatómicas) que presentan los gases nobles y las moléculas apolares, ya que estas no presentan otros tipos de interacciones más fuertes como los enlaces de hidrógeno (antiguamente, puentes de hidrógeno), interacciones dipolo-dipolo o dipolo-dipolo inducido.
Finalmente, se podría decir que las fuerzas de London son las responsables de que los átomos de los gases nobles y las moléculas apolares puedan condensar para formar líquidos o solidificarse, así sea a temperaturas muy bajas.
¿Cómo funcionan las fuerzas de London?
Como todas las demás formas de interacciones intermoleculares, las fuerzas de dispersión de London también son fuerzas de atracción electrostática.
Sin embargo, cabe hacerse la pregunta: ¿cómo es posible que se den fuerzas de atracción electrostática entre átomos o moléculas neutras y apolares?
La respuesta a esta pregunta tiene que ver con el hecho de que los electrones están en constante movimiento alrededor del núcleo y a lo largo de los enlaces químicos. A pesar de que se mueven muy rápidamente y de que, en promedio, están distribuidos de forma uniforme, puede suceder que, durante un pequeño lapso de tiempo, haya más electrones de un lado del núcleo o de un lado del enlace que del otro. Como consecuencia, se forma un dipolo eléctrico, ya que una parte del átomo (o la molécula) tendrá un exceso de cargas positivas, mientras que el otro tendrá un exceso de cargas negativas.
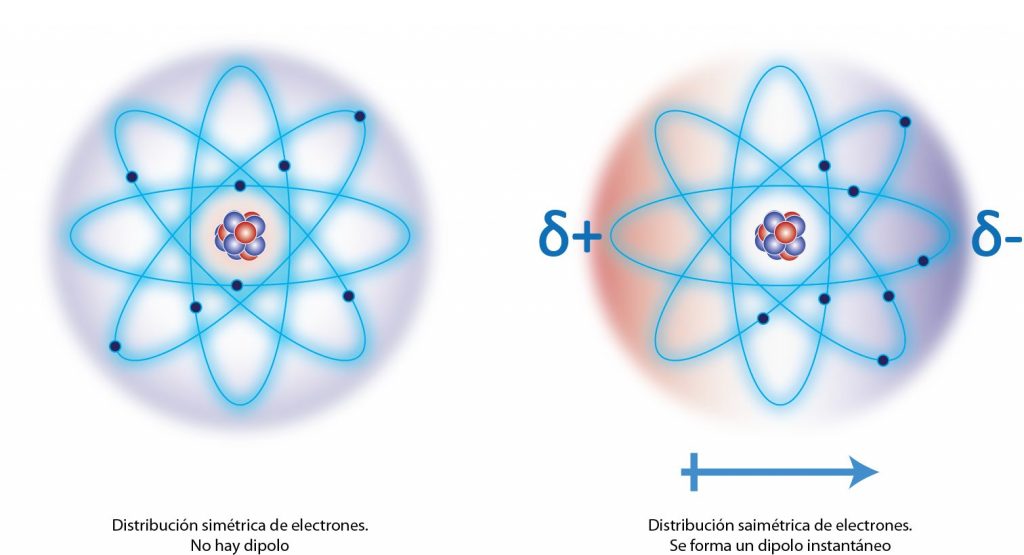
Estos dipolos se denominan dipolos instantáneos ya que duran muy poco tiempo, pero se pueden formar en cualquier parte de una molécula o de un átomo neutro. Cuando dos moléculas están muy cerca una de la otra, la formación espontánea de un dipolo en una de las moléculas induce la formación de un segundo dipolo en la otra molécula, generándose así una fuerza de atracción entre los dos dipolos, la cual es precisamente la fuerza de dispersión de London.
La razón por la que las fuerzas de London son tan débiles es porque los dipolos responsables de la atracción son muy breves y aparecen y desaparecen constantemente. Sin embargo, se pueden formar múltiples dipolos instantáneos en un momento determinado, así que mientras unos dipolos desaparecen por un lado, otros pueden aparecer por otro lado, manteniendo unidas a las dos moléculas o a los dos átomos.
Factores determinantes de las fuerzas de dispersión de London
Así como hay muchos factores que determinan qué tan fuertes son los enlaces de hidrógeno, las interacciones dipolo-dipolo y todas las demás, también hay factores que permiten determinar cuándo las fuerzas de London son más fuertes o más débiles:
Mientras más grande sea el átomo, mayor son las fuerzas de dispersión de London
Mientras más grandes son los átomos, más alejados están sus electrones de valencia del núcleo, por lo que están más débilmente unidos al mismo. Esto hace que sea más fácil deformar las nubes electrónicas para general dipolos inducidos. En otras palabras, estos átomos son más polarizables.
Mientras más polarizable sea un átomo, mayores serán los dipolos inducidos que se puedan formar por lo que mayor también serán las fuerzas de London entre los dos átomos. Esta es la razón por la que, a temperatura ambiente, el bromo es líquido mientras que el cloro y el flúor son gases, y el yodo es sólido, a pesar de que todos los halógenos forman molécula diatómicas apolares con la misma forma.
La superficie de contacto
Como regla general, mientras mayor es la superficie de contacto entre dos moléculas, mayor serán las fuerzas de dispersión de London entre ellas.
La razón por la que esto sucede es que, mientras mayor sea la superficie de contacto entre dos moléculas (o, incluso, entre dos superficies cualesquiera) habrá más dipolos instantáneos formándose en cualquier momento. A pesar de que los dipolos instantáneos son muy débiles, la formación de muchos dipolos instantáneos que se suman en un momento dado genera una gran fuerza neta de atracción entre las dos moléculas.
Esta es la razón por la cual los isómeros lineales de los alcanos siempre tienen un mayor punto de ebullición y de fusión que sus contrapartes ramificados, ya que mientras menos ramificado sea un compuesto, más largo será y, por lo tanto, mayor superficie de contacto tendrá con otra molécula igual.
Referencias
Brown, T. (2021). Quimica: La Ciencia Central. (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
Rutherford, J. (2005). van der Waals Bonding and Inert Gases. Encyclopedia of Condensed Matter Physics, 286–290. https://doi.org/10.1016/b0-12-369401-9/00407-1



