Tabla de Contenidos
El carácter metálico de un elemento hace referencia aún conjunto de propiedades físicas y químicas que son características de aquellos elementos que comúnmente se clasifican como metales. Incluye a elementos como el sodio, el francio, el aluminio y el mercurio, entre muchos otros.
¿De qué está compuesto el carácter metálico?
- Poseer puntos de fusión y ebullición altos, por lo que son sólidos a temperatura ambiente (a excepción del mercurio, que es líquido).
- Presentar brillo metálico.
- Ser dúctiles, es decir, que se puedan extender para formar alambres largos.
- Ser maleables, es decir, que se puedan aplastar para formar láminas delgadas.
- Poseer alta densidad.
- Tener tendencia a perder sus electrones de valencia para formar cationes (iones positivos).
- Poseer baja electronegatividad.
- Poseer baja energía de ionización.
- Tener buena conductividad, tanto eléctrica como térmica.
- Tienden a formar enlaces metálicos o enlaces iónicos, pero rara vez y salvo algunas excepciones, presentan enlaces covalentes.
¿En qué puede emplearse el carácter metálico?
El carácter metálico es un término que se utiliza principalmente de forma comparativa para dar una idea de qué elemento tiene más marcadas estas propiedades y cuál no. Por ejemplo, si se dice que determinado elemento posee mucho carácter metálico, significa que presenta una conductividad eléctrica marcadamente alta, una gran tendencia a perder electrones y a convertirse en un catión, etcétera.
Este término no se usa exclusivamente con los elementos metálicos
Al hablar de carácter metálico, es natural pensar que es un término que aplica solo a aquellos elementos que se consideran tradicionalmente como metales. Sin embargo, no tiene por qué ser así.
Como se trata de un término relativo y no absoluto, se puede decir que cierto elemento no metálico tiene más carácter metálico que otro elemento no metálico distinto, a pesar de ninguno de los dos es en realidad un metal.
Además de esto, es una realidad que la división entre metales y no metales es bastante difusa, y que además hay elementos no metálicos que exhiben propiedades propias de los metales, mientras que también existen elementos metálicos que presentan propiedades físicas y químicas de los no metales.
En el primer caso, resulta conveniente utilizar el término “carácter” metálico para resaltar alguna propiedad de un no metal que se asemeja a las propiedades de un metal.
Tomemos como ejemplo al elemento carbono. Nadie discute el hecho de que el carbono es un no metal. Es más, el carbono posee la mayoría de las características clásicas de los no metales, incluida su capacidad de formar aniones y enlaces covalentes. Sin embargo, existen algunos alótropos del carbono que presentan una gran conductividad eléctrica, lo cual es característico de los metales. En este caso, se puede decir que dicho alótropo del carbono posee carácter metálico, concretamente conductividad eléctrica.
¿Carácter metálico o metalicidad?
Carácter metálico a veces se confunde con el término “metalicidad”. La razón es porque en el campo de la química, ambos términos se suelen utilizar como si fueran sinónimos, es decir, se utilizan para referirse a la naturaleza metálica de una muestra.
Sin embargo, se debe tener cuidado, ya que la metalicidad es un término utilizado en astrofísica con un significado muy diferente. En dicho campo, la metalicidad de una muestra se refiere a la abundancia relativa en un lugar de elementos más pesados que el hidrógeno y el helio, independientemente de si se trata de elementos metálicos o no.
¿Cómo identificar el carácter metálico de un elemento?
- Brillo metálico
- Conductividad eléctrica y térmica
- Maleabilidad y ductilidad
- Sonido metálico
- Densidad
- Reactividad química
¿Cómo se clasifican los elementos según el carácter metálico?
Su carácter metálico se divide en 3 que son: Metálicos, No metálicos y metaloides.
Tendencia periódica del carácter metálico
Todas las propiedades que definen el carácter metálico presentan una tendencia más o menos uniforme en la tabla periódica, y en todos los casos esta tendencia apunta en la misma dirección, que es hacia el francio.
Por ejemplo, la electronegatividad y la energía de ionización son medidas de la fuerza con la que los átomos atraen a sus electrones más externos, y ambas decrecen a medida que se baja dentro de un grupo de la tabla periódica, o se mueve hacia la izquierda a lo largo de un período. El que estas propiedades decrezcan significa que aumenta el carácter metálico.
Adicionalmente, una consecuencia de esta tendencia, es que a medida que se baja o se va hacia la izquierda en la tabla periódica, también se hace más fácil perder los electrones de valencia para transformarse en un catión, lo cual también implica un mayor carácter metálico.
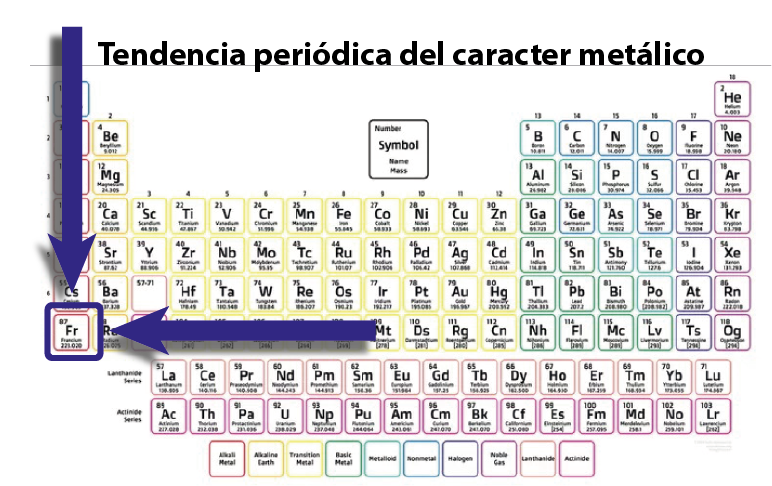
En pocas palabras, el francio, que se encuentra en la esquina inferior izquierda de la tabla periódica, es el elemento más metálico (o de mayor carácter metálico) que se conoce, y mientras más cerca del francio en la tabla periódica esté un elemento, mayor será su carácter metálico.
Ejemplos de carácter metálico
A continuación te compartimos estos ejemplos de carácter metálico de los siguientes elementos:
- Hierro (Fe)
- Cobre (Cu)
- Aluminio (Al)
- Oro (Au)
- Plata (Ag)
Si quieres saber más sobre la tabla periódica, esto puede ser para ti: ¿Cuáles son los primeros 20 elementos de la tabla periódica?
Referencias
Juan Ramos. Complete list of metals and non metals. Recuperado de https://www.sciencetrends.com
La periodicidad. (2020, November 6). Recuperado de https://espanol.libretexts.org/@go/page/1952
La ocurrencia y preparación de los metales representativos. (2020, November 10). Recuperado de https://espanol.libretexts.org/@go/page/1953



