Tabla de Contenidos
Las leyes de la termodinámica son un conjunto de cuatro enunciados que describen cómo se transforma la energía y el modo en que se transmite desde un sistema a otro o entre un sistema y el entorno del mismo. Estas leyes son de inmensa importancia para la ciencia, ya que nos ayudan a entender la razón por la que ocurren muchos de los fenómenos que venos a diario.
En este sentido, ningún fenómeno es más especial e impresionante que la vida misma, y esta no se escapa a las leyes de la termodinámica. A continuación, exploraremos cómo estas leyes se aplican a los sistemas biológicos, y como nos ha ayudado a entender desde los procesos más simples, como la difusión pasiva a través de una membrana, hasta la compleja maquinaria permite transformar nuestros alimentos en energía para mantener la vida.
Las leyes de la termodinámica son cuatro:
- La ley cero.
- La primera ley de la termodinámica.
- La segunda ley de la termodinámica.
- La tercera ley de la termodinámica.
Sin embargo, de las cuatro leyes, la ley cero es relativamente trivial y la tercera tey tiene pocas aplicaciones directas en el campo de la biología, así que, en el presente artículo, solo cubriremos de manera superficial la ley cero y la tercera ley.
Los sistemas termodinámicos en biología
Para comprender bien la termodinámica en general, se debe empezar comprendiendo lo que es un sistema termodinámico. Este se refiere a la porción del universo que estamos estudiando. Al resto del universo que no forma parte del sistema se le denomina entorno.
Dependiendo de las características de sus paredes o de la frontera entre el sistema y el entorno, los sistemas pueden ser aislados, cerrados o abiertos. Los sistemas biológicos son, por lo general, sistemas abiertos que permiten el paso tanto de energía como de materia desde el entorno hacia el sistema y viceversa.
La ley cero
La ley cero tiene que ver con el equilibrio térmico, es decir, la condición en la que dos cuerpos que están en contacto térmico no intercambian calor entre sí. Esta ley se puede enunciar del modo siguiente:
Dos sistemas en equilibrio térmico con un tercero, también están en equilibrio térmico entre sí.
Esto se ilustra en la siguiente figura. Si los sistemas A y B están en equilibrio térmico y los sistemas B y C también, entonces, los sistemas A y C deben estar en equilibrio térmico.
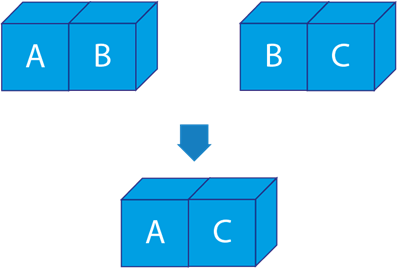
Aplicación de la ley cero en los sistemas biológicos
Como acabamos de observar, la ley cero permite establecer cuándo dos sistemas están en equilibrio térmico. Esta ley la aplicamos sin darnos cuenta cada vez que tomamos una medida de temperatura con un termómetro.
Por ejemplo, si dejamos en contacto el termómetro con el interior de nuestra boca (que es un sistema biológico), eventualmente se alcanzará el equilibrio térmico entre el vidrio del termómetro y la boca. Sin embargo, al leer la temperatura gracias al mercurio que está dentro, damos por sentado que el mercurio también estará en equilibrio térmico con la boca, a pesar de no estar en contacto directo con la misma.
Sin embargo, ya que el mercurio está en contacto con el vidrio y alcanza el equilibrio térmico con este, y el vidrio alcanza el equilibrio térmico con la boca, entonces la ley cero establece que el mercurio también debe estar en equilibrio térmico con la boca.
La primera ley de la termodinámica
La primera ley es la ley de la conservación de la energía. Esta establece que la energía en el universo es constante. Ni se crea, ni se destruye, solo se transforma. Esto significa que nunca podrá ocurrir ningún proceso dentro de ningún sistema (sea biológico o no) en el cual el sistema gane energía de algún tipo sin que el entorno la pierda.
Esta ley tiene una forma matemática muy simple que es:

donde U representa la energía interna del sistema, q es la cantidad de calor que entra al sistema, y w es la cantidad de trabajo el sistema transmite al entorno. En algunos casos, el trabajo se escribe con signo positivo, pero se reemplaza por el trabajo que hace el entorno sobre el sistema; en cualquier caso, el significado de ambas ecuaciones es exactamente el mismo.
Aplicación de la primera ley en los sistemas biológicos
Es muy fácil entender la aplicación de la primera ley a los sistemas biológicos de cualquier tamaño, desde una pequeña bacteria, hasta un ser humano o una secuoya gigante. Se trata simplemente de un equilibrio de energía.
Ejemplo de la aplicación de la primera ley en los sistemas biológicos
Podemos ver a nuestros alimentos como fuentes de energía, las “calorías» que comemos. La grasa corporal, que es una de las formas como el cuerpo almacena energía, representa el nivel de energía interna, mientras que w, el trabajo que hace el sistema, es el ejercicio. Visto así, la primera ley nos da una explicación muy sencilla para entender por qué engordamos. Siempre que comamos alimentos, es decir, calorías, si no las quemamos haciendo ejercicio para devolverlas al entorno, entonces estas se van a almacenar en forma de energía interna, es decir, en forma de grasa corporal.
Todo aquel que quiera adelgazar, debe asegurarse de que q (lo que come) sea menor que w (la energía que gasta al hacer ejercicio y desarrollar sus funciones vitales).
Esta ley nos permite establecer de manera clara qué procesos son posibles y cuáles son imposibles. Adelgazar ingiriendo más calorías de las que quemamos es sencillamente imposible, por mucho que nos quieran convencer de ello.
La segunda ley de la termodinámica
La segunda ley establece que, en todo proceso natural o espontáneo, siempre se pierde parte de la energía interna en forma de calor. Esto explica por qué una pelota que se suelta desde cierta altura y se deja botar, cada vez que lo hace alcanza una altura menor, hasta que termina en reposo en el suelo.
Si nos basamos en la primera ley, la energía potencial que estaba almacenada en la pelota originalmente tuvo que haberse ido a alguna parte. La segunda ley establece que dicha energía se disipó en forma de calor hacia el entorno.
Aplicación de la segunda ley en los sistemas biológicos
La segunda ley tiene muchísimas implicaciones en la biología y en los sistemas biológicos. Sin embargo, para entender cómo se aplica a esta rama de la ciencia, primero debemos comprender los conceptos de entropía y de energía libre de Gibbs, y cómo estas se relacionan con la segunda ley.
La entropía
Siempre que se habla de la Segunda Ley, se habla de la entropía, un concepto físico que se representa con la letra S. La entropía se descubrió originalmente como una función de estado cuyo cambio durante un proceso termodinámico es una medida de la cantidad de calor disipado durante dicho proceso. Sin embargo, un científico llamado Ludwig Boltzmann descubrió que la entropía es, en realidad, una medida del desorden de un sistema.
Por medio de diversas manipulaciones matemáticas, se llegó a la conclusión de que la segunda ley se podía enunciar en términos de la variación de entropía del universo (ΔSU) como sigue:
Todo proceso natural o espontáneo, necesariamente implica un aumento en la entropía del universo.
Es decir, que la entropía y la Segunda Ley nos proporciona una herramienta para predecir cuándo un proceso será espontáneo y cuándo no. Además, nos da una explicación sobre la tendencia de todos los procesos en el universo desde el Big Bang. Podríamos decir que todo lo que ocurre en el universo en la actualidad va encaminado a disipar en forma de calor toda la energía que fue liberada durante la formación del universo.
La energía libre de Gibbs
A nivel práctico, la segunda ley se aplica a los sistemas biológicos por medio de otra función de estado llamada energía libre de Gibbs, representada por la letra G. Como su nombre indica, esta consiste en la cantidad máxima de energía que un sistema es libre de utilizar para hacer un trabajo distinto al de expansión. Esto es particularmente relevante en la biología y la bioquímica, ya que incluye el trabajo en procesos tales como la difusión a través de membranas (sea activa o pasiva), todas las reacciones de catálisis enzimática, los procesos electroquímicos (incluidos los potenciales de acción en las neuronas y las células musculares), etcétera.
La importancia de la energía de Gibbs es que, bajo las condiciones normales en las que la vida y los procesos biológicos ocurren, la variación de la energía libre de Gibbs, es decir, ΔG, se relaciona directamente con la variación de la entropía del universo (ΔSU), de tal forma que si conocemos el signo de ΔG, entonces podemos inferir el signo de ΔSU, por lo que la podemos utilizar como criterio de espontaneidad para las reacciones químicas y demás procesos que ocurren dentro de las células de nuestro cuerpo.
Los criterios de espontaneidad se resumen en la siguiente tabla:
| Signo de ΔG | Signo de ΔSU | Espontaneidad del proceso |
| ΔG > 0 (positivo) | ΔSU < 0 (negativo) | Proceso espontáneo |
| ΔG < 0 (negativo) | ΔSU > 0 (positivo) | Proceso no espontáneo |
| ΔG = 0 | ΔSU = 0 | Sistema en equilibrio termodinámico |
El acoplamiento de reacciones bioquímicas
Los procesos que tienen una variación de energía libre negativa y que, por lo tanto, son espontáneos, liberan energía, por lo que se denominan procesos exergónicos o exotérmicos. Por otro lado, los que tienen un ΔG negativo no son espontáneos, absorben energía y se denominan endergónicos o endotérmicos.
En pocas palabras, los procesos espontáneos liberan energía de forma natural, mientras que los procesos no espontáneos no pueden ocurrir espontáneamente a menos que se proporcione la energía libre necesaria para que ocurran. Esto significa que se puede utilizar una reacción espontánea para proporcionar la energía necesaria para que ocurra otra que no es espontánea.
Para entender esto mejor, imaginemos un automóvil que está en la base de una montaña. Sería muy raro verlo escalar la montaña de forma espontánea con el motor apagado y sin ninguna ayuda. Sin embargo, al encender el motor, la combustión de la gasolina o el flujo de electricidad liberan grandes cantidades de energía de forma espontánea, energía que se utiliza para mover las ruedas e impulsar al auto hacia arriba. De esta forma, se acopló un proceso espontáneo con otro no espontáneo.
Ejemplo de la aplicación de la segunda ley en los sistemas biológicos
El ejemplo más importante de la aplicación de esta ley a los sistemas biológicos es el uso del ATP como fuente de energía para impulsar la mayoría de las reacciones bioquímicas que mantienen la vida en marcha.
La hidrólisis del ATP es un proceso fuertemente exotérmico (tal como lo es la combustión de la gasolina en el ejemplo anterior). Las enzimas que se encuentran dentro de las células utilizan esta y otras reacciones de hidrólisis espontáneas para liberar la energía que necesitan para impulsar otras reacciones bioquímicas esenciales para la vida como, por ejemplo, la biosíntesis de proteínas y de ácidos nucleicos.
La tercera ley de la termodinámica
La tercera ley (o tercer principio) establece que todo sistema tiene a perder entropía a medida que la temperatura desciende, y que alcanza ese mínimo en el cero absoluto. Para el caso de sólidos cristalinos monoatómicos perfectos, la entropía en el cero absoluto es de cero.
Esta ley permite entender a la entropía como una escala absoluta, y además permite determinar el valor de la entropía absoluta de cualquier sustancia en cualquier conjunto de condiciones de temperatura y presión.
Aplicación de la tercera ley en los sistemas biológicos
La utilidad de esta ley radica en que nos permite tener una medida directa del verdadero nivel de desorden de las distintas sustancias químicas bajo distintas condiciones, y facilita en gran medida el cálculo teórico de las variaciones de entropía (y por extensión, de la energía libre de Gibbs) para cualquier reacción química, incluidas las reacciones bioquímicas que ocurren en los sistemas biológicos.
Referencias
Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry (Ed. rev.). Oxford, United Kingdom: Oxford University Press.
Chang, R. (2008). Fisicoquímica (3ra ed.). New York City, New York: McGraw Hill.
Clark, M. A., Douglas, M., & Choi, J. (2018, 28 marzo). 6.3 The Laws of Thermodynamics – Biology 2e | OpenStax. Recuperado de https://openstax.org/books/biology-2e/pages/6-3-the-laws-of-thermodynamics
Khan Academy. (2017). Las leyes de la termodinámica (artículo). Recuperado de https://es.khanacademy.org/science/ap-biology/cellular-energetics/cellular-energy/a/the-laws-of-thermodynamics
Máxima U., J. Para: Caracteristicas.co. (2021, 26 mayo). Leyes de la Termodinámica. Recuperado de https://www.caracteristicas.co/leyes-de-la-termodinamica/
Nelson, D. L., Cox, M. M., & Foix, C. C. M. (2018). Principios de Bioquímica Lehninger (1.a ed.). Barcelona, España: EDICIONES OMEGA, S.A.



