Tabla de Contenidos
El pOH de una solución se define como el negativo del logaritmo base 10 de la concentración molar de iones hidróxido presentes en dicha solución, es decir:
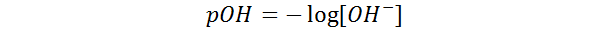
Así como el pH es una medida de la acidez de una solución, el pOH es una medida de su basicidad.
A veces resulta confusa la razón por la que el pOH existe y por qué se utiliza, si la escala de pH proporciona la misma información que la de pOH, aunque sea de forma indirecta. En otras palabras, no hay nada de información que nos pueda dar el pOH que no nos dé ya el pH de una solución.
Sin embargo, existen muchas situaciones en las que es más fácil calcular el pOH que calcular el pH. Un ejemplo se da cuando preparamos soluciones de bases fuertes o débiles, y otro incluso más notorio es al preparar soluciones buffer a partir de una base débil y una sal de su ácido conjugado.
En general, siempre que estamos en presencia de una solución básica, el cálculo del pOH se puede llevar a cabo de una manera análoga al cálculo del pH de una solución ácida, simplemente intercambiando en todas partes a los iones hidronio (H3O+) por los iones hidróxido (OH.), pH por pOH, al ácido fuerte o débil por una base fuerte o débil y a la constante de acidez (Ka) por la constante de basicidad (Kb).
En las siguientes secciones, exploraremos el proceso para calcular el pOH en diferentes situaciones y a partir de diferentes tipos de datos. Sin embargo, primero haremos un breve repaso de los conceptos fundamentales relacionados con el equilibrio ácido-base en solución acuosa.
El equilibrio iónico del agua
La acidez o basicidad de una solución acuosa es determinada por dos factores: el ácido o la base que actúa como soluto, y el agua, que es el solvente. El agua representa la parte más importante del concepto de acidez y basicidad y, de hecho, determina lo que entendemos por una solución ácida, básica y neutra.
Al mismo tiempo, el agua es la que define tanto la escala de pH como la de pOH, y esto lo hace gracias a un equilibrio ácido-base que ocurre constantemente en cualquier muestra de agua, en la que una molécula de agua actúa como ácido mientras que otra actúa como base:

Como el agua se está protonando e hidrolizando a sí misma, a esta reacción se le denomina reacción de autoprotólisis del agua. Alternativamente, esta ecuación se puede escribir de forma simplificada como una disociación simple:
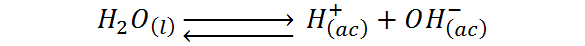
Esta reacción es una reacción reversible que alcanza rápidamente el equilibrio. Tiene asociada, por lo tanto, una constante de equilibrio la cual se denomina constante del producto iónico del agua, o KW, y que viene dada por
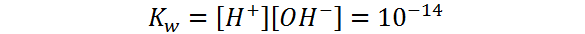
Tomando el logaritmo negativo de base 10 en ambos miembros de esta ecuación, aplicando algunas propiedades de los logaritmos y utilizando las definiciones de pH y de pOH, esta ecuación se transforma en:
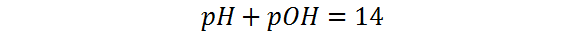
Por estequiometría, en el agua pura (que se considera neutra) las concentraciones de protones (o iones hidronio) e hidróxido son iguales entre sí y valen 10-7 M. En una solución ácida, hay una mayor concentración de iones hidronio, y en una solución básica hay una mayor concentración de iones hidróxido. En base a estos datos, podemos llegar a las siguientes conclusiones respecto a la acidez y basicidad de una solución:
- Una solución neutra tiene tanto un pH como un pOH de 7.
- Una solución ácida tiene un pH<7 y un pOH>7.
- Una solución básica tiene un pH>7 y un pOH<7.
El concepto de ácidos y bases
Para poder calcular el pOH de cualquier solución, debemos primero determinar qué tipo de solutos contiene. En general, distinguiremos entre tres tipos de solutos:
- Solutos ácidos, o, simplemente, ácidos.
- Solutos básicos o bases.
- Solutos neutros
Por simplicidad, utilizaremos el concepto de ácidos y bases de Brønsted y Lowry según el cual un ácido es cualquier sustancia capaz de ceder un protón a otra, y una base es cualquier sustancia capaz de aceptar un protón. Por otro lado, un soluto será neutro cuando no sea capaz de hacer ninguna de las dos cosas.
El equilibrio ácido-base
Al hablar de ácidos y bases, también es necesario distinguir entre dos clases de ácidos y dos clases de bases. Ambos pueden ser tanto ácidos o bases fuertes como ácidos o bases débiles. La diferencia entre ambos es que, en el segundo caso, está involucrado una reacción reversible o equilibrio ácido-base, mientras que en el caso de los ácidos y bases fuertes se asume que se disocian o reaccionan completamente (no se establece un equilibrio).
Esto es de gran importancia ya que, al momento de calcular el pOH de una solución, si se trata de ácidos o bases débiles, debemos resolver un equilibrio químico, mientras que, si son fuertes, no.
Cálculo del pOH de soluciones de ácidos y bases fuertes
Comencemos por el caso más sencillo que corresponde al cálculo de pOH de soluciones de ácidos y bases fuertes. Para mantener una forma consistente de resolver los problemas, utilizaremos en todos los casos de ácidos y bases una tabla ICE (Concentraciones iniciales, cambio y concentraciones en el equilibrio), para mostrar de forma clara cómo cambian las concentraciones de los distintos iones al disociarse o hidrolizarse los solutos respectivos.
Caso 1: Ácidos fuertes
Para calcular el pOH de una solución de un ácido fuerte, se parte de la concentración molar del ácido y de la ecuación de su disociación. Con la concentración inicial del ácido, se calcula, por estequiometría, la concentración de protones o iones hidronio en la solución. Con esta concentración se determina el pH y luego este se utiliza para calcular el pOH por medio de la ecuación anterior.
Ejemplo 1: Determinar el pOH de una solución de ácido clorhídrico 10-4 molar.
El ácido clorhídrico, o HCl, es un ácido fuerte y su reacción de disociación viene dada por:

La tabla ICE para el HCl, en este caso sería:
| HCl | H2O | H3O+ | Cl– | |
| Conc. iniciales | 10-4 M | — | 0 | 0 |
| Cambio | –10-4 M | — | +10-4 M | +10-4 M |
| Conc. en el Equilibrio | 0 | — | 10-4 M | 10-4 M |
Como se puede ver, se parte de una concentración nula de iones hidronio y cloruro. Luego se disocia completamente todo el HCl tras lo cual se forma 10-4 M tanto de iones hidronio como de iones cloruro, por lo que, una vez alcanzado el equilibrio, no queda nada de HCl y la concentración de iones hidronio es 10-4 M.
Utilizando la definición de pH:
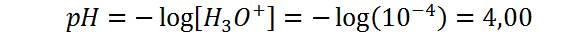
Finalmente, el pOH lo calculamos restando el pH de 14:
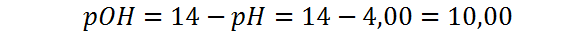
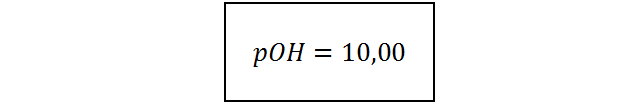
Como era de esperarse, el pOH de la solución es mayor que 7, lo cual concuerda con el hecho de que el soluto es un ácido.
Caso 2: Bases fuertes
En el caso de las bases fuertes, el proceso es un poco más directo, ya que la base, al disolverse, genera directamente los iones hidróxido. Estos se determinan por estequiometría con la ayuda de una tabla ICE, y finalmente se aplica la fórmula para calcular el pOH directamente.
Ejemplo 2: Determinar el pOH de una solución de hidróxido de sodio 10-3 molar.
El hidróxido de sodio, o NaOH, es una base fuerte y su reacción de disociación viene dada por:
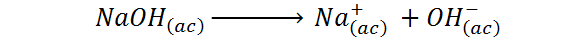
La tabla ICE para el NaOH, en este caso es:
| NaOH | Na+ | OH– | |
| Conc. iniciales | 10-3 M | 0 | 0 |
| Cambio | –10-3 M | +10-3 M | +10-3 M |
| Conc. en el Equilibrio | 0 | 10-3 M | 10-3 M |
Nuevamente, se parte de una concentración nula de iones sodio e hidróxidos. Luego se disocia completamente todo el NaOH por ser una base fuerte, tras lo cual se forma 10-3 M tanto de iones sodio como de iones hidróxido, por lo que, una vez alcanzado el equilibrio, no queda nada de NaOH y la concentración de iones hidróxido es 10-3 M.
Ahora, utilizando la definición de pOH:
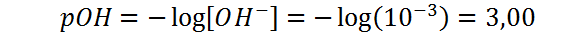

En este caso, el pOH es menor que 7, concordando con el hecho de que se trata de una base.
Caso 3: Ácidos débiles
El proceso general para calcular el pOH de una solución de un ácido débil sigue los mismos pasos que para el caso de los ácidos fuertes, con la diferencia de que la concentración de hidronios no la podemos obtener directamente de la tabla ICE, ya que no sabemos qué fracción del ácido se disocia antes de alcanzar el equilibrio.
En función de lo anterior, se debe incluir un paso adicional al procedimiento que consiste en resolver el equilibrio para hallar la concentración final de iones hidronio. Esto se hace utilizando la constante de disociación del ácido débil.
Ejemplo 3: Determinar el pOH de una solución de ácido acético 10-4 molar sabiendo que tiene una constante de disociación ácida de 1,75.10-5.
El ácido acético es un ácido orgánico débil y su reacción de disociación viene dada por el siguiente equilibrio químico:

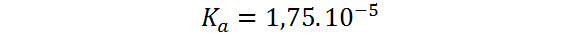
La siguiente tabla ICE relaciona las concentraciones iniciales con las finales. En este caso, como no sabemos de antemano cuánto ácido realmente se disocia, entonces el cambio en su concentración debe expresarse como una incógnita (x).
| HAc | H2O | H3O+ | Ac– | |
| Conc. iniciales | 10-4 M | — | 0 | 0 |
| Cambio | –X | — | +X | +X |
| Conc. en el Equilibrio | 10-4–X | — | X | X |
Para hallar la incógnita, X, basta con utilizar la relación entre las concentraciones de todas las especies en el equilibrio, la cual viene dada por la constante de acidez:
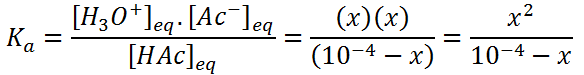
Esta ecuación se puede reescribir como:
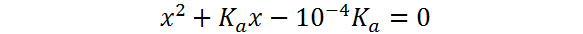
la cual es una ecuación de segundo grado que se puede resolver fácilmente utilizando la fórmula cuadrática o utilizando una calculadora científica con la función adecuada. La solución de esta ecuación, luego de sustituir el valor de la constante de acidez, es:
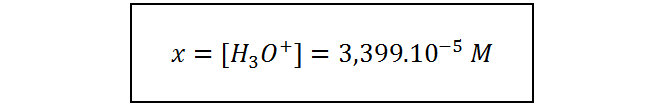
Ahora, utilizando esta concentración de iones hidronio, calculamos el pH y con este el pOH, como hicimos antes.
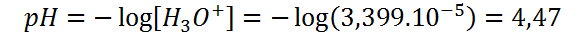
Finalmente, el pOH lo calculamos restando el pH de 14:
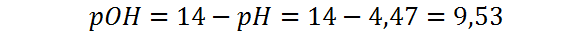

Nótese en este caso que el pOH es menos ácido que en el caso del HCl, a pesar de que ambos ácidos están a la misma concentración. Esto se debe a que este es un ácido débil mientras que el otro era uno fuerte.
Caso 4: Bases débiles
El cálculo del pOH de las bases débiles combina lo aplicado en el caso de las bases fuertes y los ácidos débiles, a saber, se debe resolver un equilibrio químico como en el segundo, pero se obtiene directamente la concentración de OH– y para luego calcular el pOH como en el primero.
Ejemplo 4: Determinar el pOH de una solución de anilina 10-2 molar sabiendo que tiene una constante de basicidad de 7,4.10-10.
Nuevamente partimos de la reacción de disociación de la base, pero en este caso se trata de una base débil así que se establece el siguiente equilibrio:

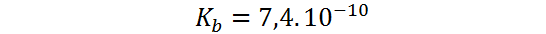
Por simplicidad, se representa a la anilina como una base genérica B. La tabla ICE se llena de manera análoga al caso anterior:
| B | H2O | BH+ | OH– | |
| Conc. iniciales | 10-2 M | — | 0 | 0 |
| Cambio | –X | — | +X | +X |
| Conc. en el Equilibrio | 10-2–X | — | X | X |
Nuevamente, la incógnita X la hallamos por medio de la constante de basicidad:
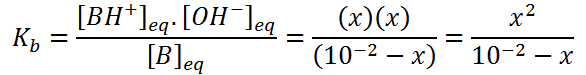
Igual que antes, esta ecuación se puede reescribir como una ecuación de segundo grado:
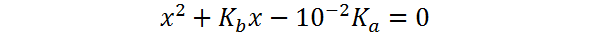
cuya solución es:

Con esta concentración podemos calcular directamente el pOH:
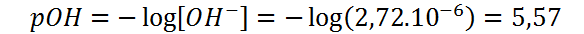
Este es un valor alcalino o básico de pOH, lo que era de esperarse considerando que se trata de una solución de anilina que es una base. Sin embargo, se puede notar que, a pesar de que la anilina en esta solución está 100 veces más concentrada que el hidróxido de sodio en la solución básica anterior, la concentración de iones hidróxido es 365 veces más pequeña, lo que es consecuencia del hecho de que se trata de una base considerablemente débil.
Caso 5: Cálculo del pOH de un sistema buffer o solución amortiguadora de pH
Las soluciones amortiguadoras son mezclas de un ácido débil y una sal de su base conjugada o de una base débil con una sal de su ácido conjugado. En ambos casos, el pH y el pOH se pueden calcular utilizando la ecuación de Henderson-Hasselbalch. Esta ecuación tiene dos formas según se trate de un ácido débil y su base conjugada o una base débil y su ácido conjugado:
Sistema buffer ácido débil/base conjugada:
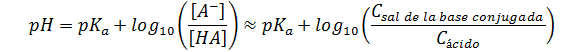
Sistema buffer base débil/ácido conjugado:
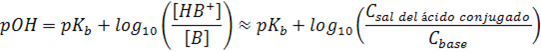
donde pKa y pKb son, respectivamente, los logaritmos negativos de base diez de la constante de acidez y basicidad.
Ejemplo 5: Determinar el pOH de una solución buffer que contiene ácido acético 0,5 M y acetato de sodio 0,3 M, sabiendo que la constante de acidez del ácido acético es 1,75.10-5.
Este sistema corresponde a un buffer de ácido débil con una sal de su base conjugada, así que, en este caso, se utiliza la primera forma de la ecuación de Henderson-Hasselbalch para calcular el pH y solo después se calcula el pOH. Las concentraciones analíticas del ácido y de la sal (Cácido y Csal) se pueden tomar como buenas aproximaciones de las concentraciones respectivas de estas especies en el equilibrio:
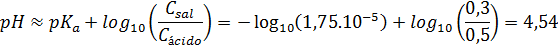

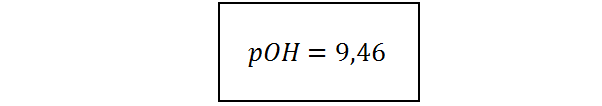
Ejemplo 6: Determinar el pOH de una solución buffer que contiene amoníaco 0,3 M y cloruro de amonio 0,5 M, sabiendo que la constante de basicidad del amoníaco es 1,8.10-5.
Este es el caso contrario al anterior. Este buffer corresponde a una base débil con una sal de su ácido conjugado. Utilizando la segunda forma de la ecuación de Henderson-Hasselbalch se puede determinar directamente el pOH:


Referencias
Corrosionpedia. (2018, 5 noviembre). pOH. Recuperado de https://www.corrosionpedia.com/definition/895/poh
Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
Covington, A. K. (1985, 1 enero). Definition of pH scales, standard reference values, measurement of pH and related terminology (Recommendations 1984). Recuperado de https://www.degruyter.com/document/doi/10.1351/pac198557030531/html
Helmenstine, A. (2021, 5 agosto). What Is pOH? Definition and Calculation. Recuperado de https://sciencenotes.org/what-is-poh-definition-and-calculation/



