Tabla de Contenidos
Las disoluciones de hidróxido de sodio son algunas de las más utilizadas en distintos tipos de laboratorios que van desde los de química hasta los de biología y bioquímica, solo por mencionar algunos. Soluciones de este soluto a diferentes concentraciones se utilizan en una gran variedad de aplicaciones que van desde reactivos químicos para síntesis orgánica, agentes titulantes en titulaciones ácido base hasta la preparación y ajuste de pH de diferentes soluciones amortiguadoras.
Cada aplicación requiere de un nivel de concentración diferente. Así mismo, incluso en aquellos casos en los que se utilizan soluciones con concentraciones similares, hay casos en los que es importante conocer de antemano dicha concentración con mucha exactitud, mientras que en otros solo se requiere conocer una concentración aproximada.
Lo anterior hace que preparar una disolución de hidróxido de sodio no sea una simple cuestión de pesar y disolver un soluto. Dependiendo de la aplicación, se requerirá tener cuidados diferentes. Además, en algunos casos se puede pueden preparar las disoluciones de hidróxido de sodio directamente a partir del soluto sólido, pero en otros casos es más conveniente prepararlas a diluyendo una disolución de partida más concentrada.
Comencemos por explorar cómo preparar una solución de hidróxido de sodio a partir del reactivo sólido.
Preparación de disoluciones de hidróxido de sodio a partir del reactivo sólido
La manera más común de preparar una disolución de hidróxido de sodio es disolviendo el reactivo en estado sólido y luego diluyendo hasta el volumen final deseado. Hay dos situaciones diferentes que requieren procedimientos diferentes en el momento de preparar la disolución.
Disoluciones de concentración aproximada
En muchas situaciones, solo necesitamos preparar disoluciones con una concentración aproximada. Por ejemplo, cuando necesitamos una disolución concentrada para utilizarla como catalizador en una reacción de hidrólisis, o cuando necesitamos una disolución para neutralizar un ácido débil en la preparación de una solución buffer.
En estos casos, no es necesario tomar demasiadas precauciones ni cuidados al pesar o preparar la disolución. Los materiales requeridos para la preparación son:

- Un vaso de precipitados de tamaño adecuado (debería ser de un volumen comparable al de la cantidad de disolución que se desea preparar).
- Matraz aforado.
- Balanza analítica.
- Espátula.
- Un pesasustancia o en su defecto papel para pesar.
- Piseta (matraz de lavado).
- Varilla de agitación.
- Embudo.
Preparación de la disolución
- Paso 1: Pesar el hidróxido de sodio.
Utilizando el pesasustancia o un papel para pesar y la balanza analítica se pesa la cantidad adecuada de hidróxido de sodio. Este suele encontrarse en forma de perlas blancas con distintos grados de pureza. Si obtener una concentración exacta no es importante, entonces no es necesario tener especial cuidado al pesar el reactivo.
Igualmente, incluso en aquellos casos en los que sí se requiere conocer con exactitud la concentración de la disolución resultante, no resulta útil pesar el hidróxido de sodio con especial cuidado, ya que este reactivo tiende a reaccionar con el dióxido de carbono del aire y contaminarse con carbonato de sodio, por lo que la masa que pesemos de este reactivo siempre será una aproximación.
La masa de hidróxido de sodio que se debe pesar depende tanto de la concentración de la solución que se desea preparar como del volumen total de la disolución final. En la siguiente tabla, se presentan las masas de hidróxido de sodio que se deben pesar para preparar distintos volúmenes de disolución de NaOH a distintas concentraciones expresadas tanto en molaridad, normalidad y porcentaje m/V.
| Concentración (M o N) | % m/V | Volumen de solución (mL) | Masa de NaOH (g) |
| 0,1 | 0,4 | 100 | 0,40 |
| 0,1 | 0,4 | 200 | 0,80 |
| 0,1 | 0,4 | 250 | 1,00 |
| 0,1 | 0,4 | 400 | 1,60 |
| 0,1 | 0,4 | 500 | 2,00 |
| 0,1 | 0,4 | 1.000 | 4,00 |
| 0,1 | 0,4 | 2.000 | 8,00 |
| 0,2 | 0,8 | 100 | 0,80 |
| 0,2 | 0,8 | 200 | 1,60 |
| 0,2 | 0,8 | 250 | 2,00 |
| 0,2 | 0,8 | 400 | 3,20 |
| 0,2 | 0,8 | 500 | 4,00 |
| 0,2 | 0,8 | 1.000 | 8,00 |
| 0,2 | 0,8 | 2.000 | 16,00 |
| 0,5 | 2,0 | 100 | 2,00 |
| 0,5 | 2,0 | 200 | 4,00 |
| 0,5 | 2,0 | 250 | 5,00 |
| 0,5 | 2,0 | 400 | 8,00 |
| 0,5 | 2,0 | 500 | 10,00 |
| 0,5 | 2,0 | 1.000 | 20,00 |
| 0,5 | 2,0 | 2.000 | 40,00 |
| 1,0 | 4,0 | 100 | 4,00 |
| 1,0 | 4,0 | 200 | 8,00 |
| 1,0 | 4,0 | 250 | 10,00 |
| 1,0 | 4,0 | 400 | 16,00 |
| 1,0 | 4,0 | 500 | 20,00 |
| 1,0 | 4,0 | 1.000 | 40,00 |
| 1,0 | 4,0 | 2.000 | 80,00 |
- Paso 2: Trasvasar el reactivo a un vaso de precipitado y disolver en agua destilada.
Dependiendo de la cantidad de disolución que se desee preparar y de la masa total de NaOH que se deba pesar, resulta conveniente disolver el reactivo en un vaso de precipitado antes de transferir la disolución al matraz aforado en el que se preparará la disolución final.
Sea que se utilice un pesasustancias o un papel para pesado, el reactivo se trasvasa a un vaso de precipitado que contenga un volumen de agua de aproximadamente la mitad del volumen de disolución que se desea preparar. Cualquier resto que quede adherido al pesasustancias o al papel se arrastra con la ayuda de la piseta.
Después, utilizando la varilla de agitación, se agita la disolución hasta disolver completamente todo el sólido.
NOTA: La reacción de disolución del NaOH es muy exotérmica, por lo que es común que esta se caliente considerablemente durante el proceso de disolución. Es recomendable llevar a cabo este proceso en un baño de hielo para absorber el calor liberado y facilitar así el proceso de disolución.
- Paso 3: Trasvasar al matraz aforado.
Una vez se logre disolver todo el sólido, el contenido del vaso de precipitado se trasvasa al matraz a través de un embudo, arrastrando cualquier resto de solución con la ayuda de una piseta.

- Paso 4: Aforar con agua destilada
Una vez todo haya sido trasvasado todo el contenido del vaso de precipitado, se sigue agregando agua hasta llenar el balón uno o dos centímetros por debajo de la marca de aforo. Se aconseja dejar reposar el matraz durante algunos minutos para asegurar que tanto el propio matraz como su contenido alcancen el equilibrio térmico. Finalmente, se termina de llenar hasta la marca de aforo utilizando la piseta.
- Paso 5: Tapar y agitar.
Una vez aforado el matraz, se procede a colocar el tapón para luego agitarlo suavemente invirtiéndolo y enderezándolo de manera tal que se mezcle bien todo el contenido y se obtenga una solución homogénea.
Disoluciones de concentración exacta
Sin importar el cuidado que se tome al preparar una disolución siguiendo el procedimiento anterior, y sin importar con cuánta exactitud se pese el hidróxido de sodio, la concentración real de la solución nunca será exactamente igual a la concentración nominal que se está preparando. Sin embargo, en muchos casos se requiere conocer la concentración exacta de la disolución recién preparada, como por ejemplo cuando se va a utilizar dicha solución como agente titulante en una titulación ácido base.
Si este es el caso, la disolución recién preparada se debe estandarizar o normalizar por medio de una titulación ácido base de un patrón primario adecuado. Un patrón primario es una sustancia de alta pureza y estabilidad que reacciona rápida y cuantitativamente con otra y que puede utilizarse como patrón para la determinación de la concentración real de una disolución.
Hay varios patrones primarios que se pueden utilizar para estandarizar soluciones de NaOH, pero el más común es el ftalato ácido de potasio o biftalato de potasio.
Estandarización con biftalato de potasio
El procedimiento aquí descrito consiste en la estandarización de una disolución de hidróxido de sodio cuya concentración sea aproximadamente 0,1 N (o molar). Para estandarizar cualquier otra solución se puede ajustar o bien la masa de patrón primario pesada, o se puede diluir primero el hidróxido de sodio hasta obtener una concentración de 0,1 N.
El procedimiento consiste en pesar con exactitud una masa de alrededor de 0,5 g de bftalato de potasio para luego disolverlo en una fiola o matraz Erlenmeyer en 25 mL de agua destilada. Se agregan unas gotas de indicador de fenolftaleína y luego se titula la solución utilizando la disolución de NaOH.
Una vez alcanzado el punto final, se toma nota del volumen de titulante y se aplica la siguiente fórmula para determinar la concentración real del hidróxido de sodio:
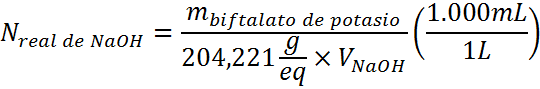
En la ecuación anterior, la masa de biftalato de potasio se debe colocar en gramos y el volumen de titulante (de NaOH) en mililitros.
Por ejemplo, si se pesaron 0,4958 g de biftalato de potasio y la titulación consumió 24,35 mL de NaOH, significa que la concentración real del NaOH es 0,0997 N.
Estandarización con ácido benzoico
La estandarización con el ácido benzoico se lleva a cabo de la misma manera que con el bftalato de potasio, con la única diferencia de que se pesan con exactitud alrededor de 0,3 g de ácido benzoico en lugar de 0,5 g como en el caso anterior. En este caso, la fórmula para determinar la concentración real del NaOH es:
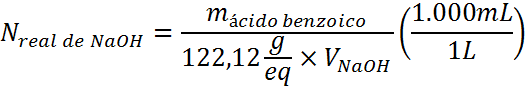
Preparación de disoluciones de hidróxido de sodio por dilución
Lo otra forma más común de preparar soluciones de NaOH es por medio de la dilución de soluciones más concentradas. En un laboratorio, es muy común preparar una disolución madre concentrada a partir de la cual se preparan distintas diluciones según sean necesarias. La solución original suele tener una concentración de 1 molar o 1 normal, o una concentración similar.
En aquellos casos en los que se requiera preparar soluciones mucho más diluidas tales como 0,01 N o 0,001 N (cosa que es muy frecuente), se suelen preparar diluciones en serie (es decir, se prepara una primera dilución, luego esta se diluye más y luego la otra se diluye más todavía, y así sucesivamente).
Para llevar a cabo las diluciones se necesita:
- Un balón aforado de la capacidad adecuada.
- Un vaso de precipitado.
- Una pipeta volumétrica de la capacidad adecuada.
- Una piseta.
El procedimiento es muy sencillo:
- Paso 1: Verter parte de la solución concentrada en un vaso de precipitado limpio y seco.
Es importante nunca tomar alícuotas directamente del recipiente en el que se encuentra la solución madre, ya que se podría contaminar y arruinar todo el lote.
- Paso 2: Con la pipeta volumétrica, medir el volumen requerido de solución concentrada.
Se debe tener cuidado en llenar la pipeta hasta la marca de aforo manteniéndola en posición vertical y asegurándose de que no haya quedado ninguna burbuja de aire.
La cantidad de solución que se debe medir y la pipeta volumétrica que se debe utilizar dependen tanto de la cantidad de solución que se desea preparar como de las concertaciones inicial y final.
- Paso 3: Transferir la solución concentrada al balón aforado limpio y seco y aforar.
Este paso consiste simplemente en trasvasar la solución concentrada al balón para luego diluir la solución con agua pura utilizando una piseta.
- Paso 5: Tapar y agitar.
Este paso es igual al paso 5 del procedimiento anterior.
Referencias
Castro S., J. M. (2013). Manual de procedimiento para la preparación de soluciones en los laboratorios de caracterización y calidad del agua y operación de plantas de tratamiento de aguas. Recuperado de https://www.repositoriodigital.ipn.mx/bitstream/123456789/26030/1/PREPARACION%20DE%20SOLUCIONES%20%28bueno%29.pdf
Pico L., X. (s. f.). Estandarización de disoluciones valorantes. Recuperado de https://xavierpicolozano.files.wordpress.com/2017/03/estandarizacion.pdf
Ramirez S., M. T., & Guzmán H., D. S. (2017). Estandarización de Hidróxido de Sodio (NaOH) 1 M. Recuperado de https://www.studocu.com/es-mx/document/universidad-autonoma-metropolitana/laboratorio-de-quimica-analitica/estandarizacion-de-hidroxido-de-sodio-naoh-1-m/2991623
Skoog, D. A., West, D. M., Holler, J., & Crouch, S. R. (2021). Fundamentos de Quimica Analitica (9th edition). Boston, Massachusetts: Cengage Learning.



