Tabla de Contenidos
Existen fundamentalmente tres tipos de enlaces químicos en la naturaleza que mantienen unidos a los átomos, moléculas e iones entre sí. Estos son el enlace iónico, el enlace covalente y el enlace metálico. De los tres, los enlaces iónicos y covalentes son los más comunes, y son los responsables de la existencia de prácticamente todos las sustancias orgánicas e inorgánicas que conocemos.
Estos dos enlaces son muy diferentes y dan origen a compuestos o sustancias iónicas y a compuestos o sustancias covalentes que poseen una serie de características y propiedades marcadamente distintas.
Más adelante, haremos una comparación del enlace iónico con el enlace covalente, resaltando las diferencias más importantes entre estos dos tipos de enlaces y las sustancias químicas que los poseen. Sin embargo, antes de llegar a ese punto y para poder comprenderlo mejor, es necesario entender la razón por la que los átomos se enlazan entre sí y qué determina el tipo de enlace que se da entre dos átomos.
¿Por qué los átomos se enlazan entre sí?
La existencia del enlace químico tiene que ver con la estabilidad de los átomos y, en particular, con su configuración electrónica. Esta se refiere a la forma particular cómo están distribuidos los electrones alrededor del núcleo de un átomo.
Resulta que, en lo que a configuraciones electrónicas se refiere, algunas son mejores que otras, y solo los elementos del grupo de los gases nobles (grupo 18 de la tabla periódica) tienen lo que podemos llamar una configuración electrónica estable. Esta configuración electrónica se caracteriza por tener los orbitales s y p de la capa de valencia completamente llenos con 8 electrones.
Ningún otro elemento de la tabla periódica tiene esta configuración electrónica tan estable, por lo que los demás átomos buscan unirse entre sí para poder así satisfacer su necesidad de rodearse de 8 y solo 8 electrones de valencia, tal como los gases nobles, dando origen al enlace químico.
A la necesidad de rodearse de 8 electrones de valencia se le denomina la regla del octeto, y existen fundamentalmente dos formas para lograrlo: ceder (cuando le sobran) o quitar (cuando le faltan) electrones de valencia a otro átomo, o compartir los electrones de valencia para satisfacerse mutuamente la misma necesidad. Según el caso del que se trate, se formará un enlace iónico o un enlace covalente.
El enlace iónico
En enlace iónico es el tipo de enlace químico que se encuentra en los compuestos iónicos. Es un enlace que se da debido a la fuerza de atracción electrostática existente entre partículas con cargas opuestas denominadas iones, y de allí su nombre. A los iones con carga positiva se les denomina cationes, mientras que a los negativos se les llama aniones.
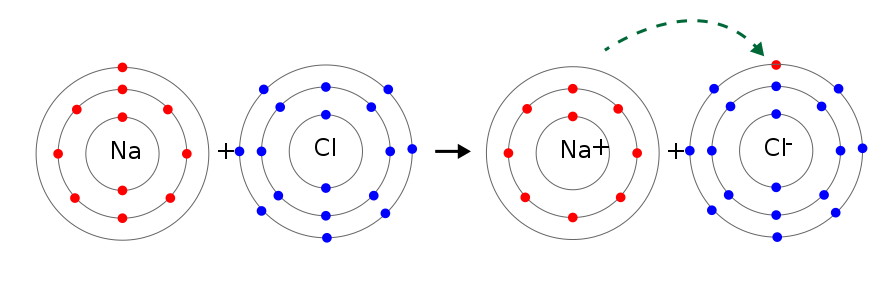
El enlace iónico se forma cuando un átomo no metálico y muy electronegativo le quita uno o más electrones a un átomo muy electropositivo (en general un metal). Cuando esto sucede, el no metal queda con carga negativa, convirtiéndose así en un anión, mientras que el metal queda con carga positiva convirtiéndose en un catión. Al tener cargas opuestas, estos iones se atraen mutuamente, formándose el enlace iónico.
El enlace covalente
El enlace covalente es un tipo de enlace que se da fundamentalmente entre átomos de elementos similares, casi siempre no metales. A diferencia del enlace iónico, en el enlace covalente no se da una transferencia neta de electrones de un átomo a otro, ya que esto solo ayudaría a completar el octeto a uno de los átomos, pero no al otro. En cambio, los átomos comparten sus electrones de valencia, a través de lo cual logran completar el octeto de ambos átomos al mismo tiempo.
Diferencias entre el enlace iónico y el enlace covalente
Ya se aclaró qué es un enlace químico y se definieron el enlace iónico y el covalente. Ahora analizaremos las principales diferencias entre estos dos tipos de enlaces y entre los compuestos que los contienen.
Tipos de elementos que unen
| Enlace iónico | Enlace covalente |
| Siempre entre elementos diferentes y además de diferentes tipos. En general se da entre metales y no metales. Ejemplo: | Se da entre átomos del mismo elemento o de elementos muy similares con electronegatividades parecidas. Casi siempre se da entre no metales y no metales. |
Los enlaces iónicos se dan principalmente entre metales y no mentales. La razón es que a los primeros siempre les sobran algunos electrones en comparación a los gases nobles, mientras que a los no metales en general le faltan algunos electrones. Por esta razón, al unirse un metal con un no metal, se da la transferencia entre ambos elementos para lograr así que ambos satisfagan la regla del octeto.
En el caso del enlace covalente, como do átomo iguales o muy similares tendrán las mismas necesidades de adquirir electrones para completar su octeto, la única forma de lograrlo es compartiendo los electrones.
Diferencias de electronegatividad
| Enlace iónico | Enlace covalente |
| Diferencia de electronegatividad > 1,7 | Covalente puro o no polar: < 0,4 Covalente polar: Entre 0,4 y 1,7 |
Una forma de saber si dos átomos formarán un enlace iónico o covalente es en función de la diferencia de sus electronegatividades. Cuando la diferencia es muy grande, el enlace será iónico, mientras que cuando es pequeña o nula, será covalente.
Entre los enlaces covalentes, se pueden distinguir los enlaces covalentes puros o no polares que se dan entre átomos idénticos (como en la molécula de H2) o entre átomos con electronegatividades muy parecidas (como entre C e H). Si hay una diferencia de electronegatividad, pero esta no es muy grande, se dan un enlace covalente en el que los electrones pasan más tiempo alrededor de uno de los átomos, dando origen a un enlace polar.
Energías de enlace
| Enlace iónico | Enlace covalente |
| Se encuentran entre 400 y 4 000 kJ/mol | Se encuentran entre 100 y 1 100 kJ/mol |
En general, el enlace iónico es más fuerte que el enlace covalente, aunque eso depende de los átomos que están enlazados. Como consecuencia, las energías de enlace en los compuestos iónicos casi siempre son mayores que las de los compuestos covalentes.
Tipos de compuestos que forman
| Enlace iónico | Enlace covalente |
| Compuestos iónicos tales como el fluoruro de litio (LiF) o el cloruro de potasio (KCl). | Compuestos moleculares como el metano (CH4) y sólidos de red covalente (o simplemente sólidos covalentes) como el diamante (alótropo del carbono). |
Los enlaces iónicos dan origen a los compuestos iónicos, mientras que los enlaces covalentes pueden dar origen bien sea a compuestos moleculares como el agua o el dióxido de carbono, como a compuestos de redes covalentes como el diamante, el grafito y las zeolitas, en los que millones de átomos están enlazados entre sí formando una red bidimensional o tridimensional que es muy estable y resistente.
Diferencias en propiedades físicas y químicas de los compuestos que forman
El hecho de poseer enlaces iónicos o enlaces covalentes le confiere a los diferentes compuestos propiedades muy distintas. En la siguiente tabla se resumen las diferencias más importantes entre los compuestos iónicos y las dos clases principales de sustancias con enlaces covalentes, a saber, las sustancias moleculares y los sólidos covalentes.
| Propiedad | Compuestos iónicos | Compuestos moleculares | Sólidos covalentes |
| Punto de fusión y ebullición | Puntos de fusión y ebullición muy altos. | Puntos de fusión y ebullición bajos | Puntos de fusión y ebullición muy altos. |
| Estado físico a temperatura ambiente | Son sólidos a temperatura ambiente. | Pueden ser tanto sólidos como líquidos o gaseosos a temperatura ambiente. | Son sólidos a temperatura ambiente. |
| Solubilidad | Suelen ser solubles en agua y otros solventes polares. | Los compuestos moleculares polares son solubles en solventes polares. Los apolares son insolubles en agua y en otros solventes polares pero solubles en muchos solventes orgánicos apolares. | No suelen ser solubles en ningún solvente. |
| Conductividad eléctrica | No conducen la electricidad en estado sólido, pero sí en solución o en estado líquido (sales fundidas). | No conducen la electricidad. Son materiales aislantes. | Algunos son conductores (como el grafito), mientras que otros no (como el diamante). |
| Tipo de estructura | Sólidos cristalinos. | Algunos son cristalinos, otros amorfos. | Sólidos cristalinos. |
| Propiedades mecánicas | Sólidos duros y frágiles | En general son blandos | Sólidos duros y frágiles |
Resumen de las diferencias entre enlace iónico y enlace covalente
| Enlace iónico | Enlace covalente | |
| Definición | Fuerza que mantiene unidos a los iones de carga opuesta en los compuestos iónicos. | Fuerza que mantiene unidos a dos átomos que comparten electrones de valencia. |
| Tipos de elementos que unen | Siempre entre elementos diferentes y además de diferentes tipos. En general se da entre metales y no metales. Ejemplo: | Se da entre átomos del mismo elemento o de elementos muy similares con electronegatividades parecidas. Casi siempre se da entre no metales y no metales. |
| Diferencias de electronegatividad | Diferencia de electronegatividad > 1,7 | Covalente puro o no polar: < 0,4 Covalente polar: Entre 0,4 y 1,7 |
| Energías de enlace | Se encuentran entre 400 y 4 000 kJ/mol | Se encuentran entre 100 y 1 100 kJ/mol |
| Tipos de compuestos que forman | Compuestos iónicos como el fluoruro de litio (LiF) o el cloruro de potasio (KCl). | – Compuestos moleculares apolares como el metano (CH4). – Compuestos moleculares polares como el agua (H2O) – Sólidos de red covalente (o simplemente sólidos covalentes) como el diamante (alótropo del carbono). |
Referencias
Brown, T. (2021). Química: La Ciencia Central (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
El enlace químico y la geometría molecular. (2020, October 29). Recuperado de https://espanol.libretexts.org/@go/page/1851



