Tabla de Contenidos
Una ecuación iónica neta es un tipo de ecuación química utilizada para representar reacciones en las que intervienen sustancias iónicas en disolución, y en la que se muestran únicamente aquellos iones que realmente intervienen en la reacción. La razón por la que se denomina ecuación iónica neta es porque se eliminan de la ecuación iónica total a todos los iones espectadores, es decir, aquellos que, a pesar de formar parte de los reactivos originales y a pesar de estar presentes en la disolución, no intervienen en la reacción química.
Las ecuaciones iónicas netas son una representación más fiel de lo que realmente ocurre cuando llevamos a cabo una reacción química entre compuestos iónicos en disolución acuosa. Al disolver un compuesto iónico, como por ejemplo una sal o un hidróxido soluble, estos se disocian por el efecto del disolvente que, en este caso, es agua. Como el término sugiere, al disociarse, los aniones y cationes de del compuesto iónico pueden reaccionar por separado de manera completamente independiente el uno del otro.
Las ecuaciones iónicas netas y las ecuaciones moleculares
Las ecuaciones iónicas netas son de gran importancia, ya que simplifican la representación de una reacción química que de otro modo podría percibirse como más compleja de lo que realmente es. Sin embargo, las ecuaciones químicas en las que se incluyen las sustancias iónicas completas con ambos iones antes de disociarse siguen siendo importantísimas y son necesarias para llevar a cabo muchos cálculos estequiométricos de forma más sencilla. Estas reacciones se denominan reacciones moleculares, ya que representan a los compuestos iónicos por medio de fórmulas equivalentes a las fórmulas moleculares neutras de los compuestos covalentes.
Una ecuación molecular contiene la información estequiométrica necesaria para calcular las masas de los reactivos que realmente podemos pesar, así como las masas de los productos que realmente podemos obtener al final de la reacción, una vez retirado el disolvente.
Debemos recordar que no podemos separar en dos frascos diferentes los iones que confirman a un compuesto iónico. Por ejemplo, no podemos tener un frasco que solo contenga iones cloruro y otro que solo contenga cationes sodio. Los aniones necesariamente estarán asociados a los cationes cuando no estén en disolución y, por lo tanto, necesariamente se pesarán juntos.
Ejemplo de una ecuación iónica neta y características básicas de las mismas
Un ejemplo ilustrativo de una ecuación iónica neta se puede escribir para la reacción entre el permanganato de potasio (KMnO4) y el yoduro de sodio (NaI), la cual produce yodo molecular (I2) y óxido de manganeso (IV) (MnO2) en medio básico. La ecuación molecular de esta reacción viene dada por:

En este caso, la ecuación molecular parece sugerir que los iones potasio de alguna manera están interviniendo en la reacción química de óxido reducción. Sin embargo, este no es el caso. Cuando se escribe la ecuación iónica neta de esta misma reacción química, el resultado es:

Como se puede ver, el ion potasio no aparece por ninguna parte. La razón es que el potasio es un ion espectador. Las sustancias que realmente intervienen en la reacción química y que contienen los átomos que cambian de estado de oxidación durante la reacción de óxido reducción son, en realidad, el ion permanganato (MnO4–) y el ion yoduro (I–).
Este ejemplo resalta algunas características básicas de las ecuaciones iónicas netas:
- Todas las especies químicas involucradas deben reflejar su estado de agregación, sin excepción. Estos estados pueden ser sólido (s), líquido (l), gaseoso (g) o en disolución acuosa (ac).
- Todas las especies iónicas deben poseer su carga eléctrica respectiva.
- La ecuación no incluye a los iones espectadores.
- Se incluye a cualquier reactivo neutro que se encuentre inicialmente en estado sólido o líquido o gaseoso y que no sea soluble en agua o cualquiera que sea soluble pero que no se disocie al disolverse.
- También se incluye a cualquier producto sólido, líquido o gaseoso que se forme durante la reacción y que cumpla las mismas condiciones anteriores.
Pasos para escribir una ecuación iónica neta
Las ecuaciones iónicas netas se pueden obtener de distintas maneras dependiendo del tipo de reacción química de que se trate. Por ejemplo, en el caso de las reacciones de óxido reducción, sus ecuaciones iónicas netas se pueden obtener a partir del proceso de ajuste de ecuaciones por el método del ion electrón.
Otra forma para obtener una ecuación iónica neta es a partir de las respectivas ecuaciones moleculares. En esta sección se muestra cómo obtener la ecuación iónica neta a partir de la ecuación molecular ajustada. Para la aplicación de los pasos tomaremos como ejemplo la reacción entre el nitrato de calcio y el fosfato de sodio para producir fosfato de calcio y nitrato de sodio.
Paso #1 – Escribir la ecuación molecular y ajustarla
El primer paso consiste en escribir la ecuación y en ajustarla o balancearla como si todas las sustancias involucradas fueran compuestos moleculares. En cada caso se debe identificar el estado de agregación de cada compuesto.
En este punto se deben tomar en cuenta las reglas de solubilidad para determinar si cada compuesto iónico es un electrolito fuerte o débil. Esto permite identificar cuáles estarán disueltos (y por lo tanto disociados) y cuáles no. Algunas reglas para asignar estos estados de agregación son:
- Los compuestos moleculares no se disocian en disolución acuosa. Si son solubles en agua, se le coloca el subíndice (ac), de lo contrario se le coloca su respectivo estado físico, sea este sólido, líquido o gaseoso.
- Todas las sales de metales alcalinos (Li, Na, K, Rb y Cs) y de amonio (NH4+) son solubles en agua y son electrolitos fuertes, por lo que se les coloca (ac).
- Todos los nitratos y percloratos son solubles en agua y son electrolitos fuertes, por lo que se les coloca (ac).
- A excepción del sulfato de plomo (II) y el de bario, todos los sulfatos son solubles, por lo que se les coloca (ac).
- Los cloruros, bromuros y yoduros que no sean de plata, plomo (II) o mercurio (II) son solubles.
- La mayoría de los fosfatos, carbonatos, cromatos, silicatos, sulfuros e hidróxidos son insolubles y además son sólidos a temperatura ambiente, por lo que se les coloca (s).
En el caso de la reacción entre el nitrato de calcio y el fosfato de sodio, la reacción molecular sin ajustar es:

Como se puede observar en este caso, el nitrato de calcio es soluble (por tratarse de un nitrato), por lo que le colocamos (ac). El fosfato de sodio también, ya que es una sal de sodio, que es un metal alcalino. En el lado de los productos, el fosfato de calcio es insoluble en agua y es sólido a temperatura ambiente, por lo que le colocamos (s). Finalmente, el nitrato de sodio también es un electrolito fuerte, así que estará disuelto y disociado.
Ahora ajustamos la ecuación para obtener la ecuación molecular balanceada:

Paso #2 – Encerrándolos entre corchetes, disociar todos los electrolitos fuertes
Esta etapa busca representar cada electrolito en disolución de la forma real como se encuentra en la misma: completamente disociado por el efecto de solvatación del disolvente. La razón por la que se coloca entre corchetes es para asegurar que el número de iones sea multiplicado por cualquier coeficiente estequiométrico que pueda tener la sal completa.
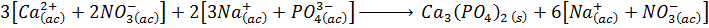
Esta ecuación química es la denominada ecuación iónica total o completa.
Paso #3 – Multiplicar todos los coeficientes estequiométricos para eliminar los corchetes
Este es el paso previo a la obtención de la ecuación iónica neta.
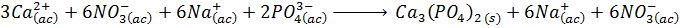
Paso #4 – Eliminar todos los iones espectadores de la ecuación
Una vez culminado este paso, tendremos ya la ecuación iónica neta. En el caso de nuestro ejemplo, esto implica eliminar los iones sodio y nitrato en ambos miembros de la ecuación, lo que los identifica como los iones espectadores en esta reacción química. Finalmente, le ecuación iónica neta que buscamos es:
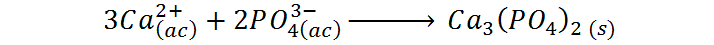
Referencias
Chang, R. (2021). Quimica (11.a ed.). MCGRAW HILL EDDUCATION.
Ecuaciones moleculares, iónicas completas e iónicas netas (artículo). (s. f.). Khan Academy. https://es.khanacademy.org/science/ap-chemistry-beta/x2eef969c74e0d802:chemical-reactions/x2eef969c74e0d802:net-ionic-equations/a/complete-ionic-and-net-ionic-equations
Juncker, M., PhD. (2021, 1 junio). How to Write a Net Ionic Equation. WikiHow. https://www.wikihow.com/Write-a-Net-Ionic-Equation
Tema 7: Equilibrio en fase acuosa. Reacciones de precipitación. (s. f.). Universidad de Granada. http://www.ugr.es/~mota/QG_F-TEMA_7-2017-Equilibrios_de_solubilidad.pdf
Youngker, A. (2018, 1 febrero). Cómo escribir la ecuación iónica neta para el CH3COOH cuando reacciona con el NaOH. Geniolandia. https://www.geniolandia.com/13114959/como-escribir-la-ecuacion-ionica-neta-para-el-ch3cooh-cuando-reacciona-con-el-naoh



