Tabla de Contenidos
La masa atómica y el peso atómico, al ser término químicos parecidos, suelen confundirse por parte de los alumnos. Mediante este artículo vamos a facilitar algunas erramientas para que esa confsión desaparezca por completo.
Empecemos por ver qué significa cada concepto.
Masa atómica
La masa atómica puede definirse como el número total de protones y neutrones presentes en un átomo, aunque esa definición no es del todo exacta. Es importante recordar que lo ideal es contar también con la masa de los electrones. Sin embargo, como la mencionada masa de los electrones es muy pequeña, suele despreciarse a la hora de hacer cálculos.
La unidad de masa atómica es el dalton. Esta unidad se representa por «Da». El dalton es la unidad estándar utilizada para indicar la masa de un átomo. La masa atómica de los diferentes elementos varía porque el número de protones y neutrones es diferente para cada elemento.
Examinemos ahora el significado de la masa isotópica relativa. Hemos establecido que la masa atómica es una masa absoluta. Pero la masa isotópica relativa, en cambio, es un número adimensional, es decir, que no tiene unidades.
Esta ausencia de unidades es el resultado de utilizar una relación de escala para el estándar de carbono-12. Además, es interesante observar que la palabra «relativa» en el concepto «masa isotópica relativa» se refiere a esta escala en relación con el estándar de carbono-12.
Basándonos en esta información, podemos decir que la masa isotópica relativa es la masa de un isótopo dado cuando el valor final se escala por la masa del carbono 12. En la misma línea y con otras palabras, también podemos afirmar que la masa isotópica relativa de un isótopo es la masa de dicho isótopo en relación con 1/12 de la masa de un átomo de carbono-12.
Cómo visualizar la masa atómica en la tabla periódica
Ahora tenemos una idea del significado de la masa atómica y de la masa atómica relativa. El siguiente paso importante es aprender el peso atómico y la diferencia entre masa atómica y número de masa atómica. No sin antes aprender a localizar el número atómico, el símbolo atómico y la masa atómica de un elemento en la tabla periódica.
Para entenderlo mejor, te dejamos la siguiente una imagen:
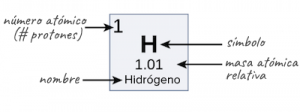
¿Qué es el peso atómico?
Desde 1961 la unidad normal de peso atómico es 1/12 de la masa atómica del isótopo del carbono-12. Sin embargo, un mismo elemento puede tener varios isótopos. Esto significa que, si se quiere calcular el peso atómico, es importante tener en cuenta las masas de los diferentes isótopos, y el porcentaje de los diferentes isótopos también puede variar.
Para esto, es importante tener presentes los valores de la abundancia relativa de los isótopos y la masa de los isótopos al calcular el peso atómico. El peso atómico también se conoce como «masa atómica relativa«. También puede definirse como la relación entre la masa media de los átomos de un elemento químico y un patrón determinado. Un isótopo también puede denominarse como una de las dos o más especies de átomos con diferente número de masa atómica del mismo elemento químico.
Ahora bien, el peso atómico también se mide en unidades de masa atómica. Esta unidad se suele abreviar como UMA, aunque también se conoce como Dalton. Antes de discutir la diferencia entre masa atómica y masa molecular, veamos brevemente la historia de este concepto.
Historia de los Daltons
John Dalton fue el primer científico que propuso que al átomo de hidrógeno debía asignársele un valor de uno. Este valor se consideró la base de su escala de peso atómico.
Posteriormente y durante varias décadas, los pesos de los núcleos atómicos se explicaron en una escala basada en 1/18 de la masa del átomo de oxígeno neutro. La unidad de peso atómico químico era entonces 1,000272 veces la unidad de masa atómica física. Este periodo de confusión llegó finalmente a su fin en 1961, tras la aceptación de 1/12 de la masa del carbono como unidad para los pesos atómicos y las masas de los núcleos.
Diferencias entre el peso atómico y la masa atómica
Ahora que sabemos qué es la masa atómica y qué es el peso atómico, destacaremos las diferencias entre estos.
Masa atómica
- Se define como la suma de los protones y neutrones que existen en un átomo específico.
- En el cálculo de la masa atómica no se incluyen los isótopos.
- El valor final obtenido es un número entero.
- Para realizar el análisis se utiliza la espectroscopia de masas.
Peso atómico
- Se define como la relación media de todos los átomos presentes en un elemento.
- Los isótopos se incluyen en el cálculo del peso atómico.
- El valor final obtenido puede ser o no un número entero.
- Se puede realizar un análisis por espectroscopia de masas.
Fuentes
- Khan Academy. (s.f.). Peso atómico y masa atómica.
- Lenntech. (s.f.). Elementos químicos ordenados por su masa atómica.
- Planas, O. (2019). ¿Qué es la masa atómica?
- Recursos Tic. (s.f.). Magnitudes y leyes básicas. Masa atómica y masa molecular.
- Rodríguez, J. y Rodríguez, D. (2000). Contribuciones históricas al desarrollo del concepto de peso atómico.



