Tabla de Contenidos
Una molécula se puede definir como un grupo de dos o más átomos unidos entre sí por medio de enlaces covalentes, formando así unidades discretas eléctricamente neutras y de composición constante que conforman las unidades más pequeñas posibles que mantienen la composición y propiedades de una sustancia química pura.
Las moléculas pueden estar compuestas por la misma clase de átomos, formando así especies homonucleares correspondientes a los distintos alótropos de los elementos químicos. Por ejemplo, el oxígeno gaseoso es un alótropo del oxígeno formado por moléculas de O2 (es decir moléculas de dos átomos de oxígeno), mientras que las moléculas de ozono (O3) están formadas por tres átomos de oxígeno y representan otro alótropo natural de dicho elemento.
Las moléculas también pueden estar conformadas por átomos de más de un elemento, dando origen a compuestos químicos moleculares. El ejemplo más sencillo es el agua, la cual está conformada por moléculas de H2O, formadas por dos átomos de hidrógeno enlazados a un átomo de oxígeno.
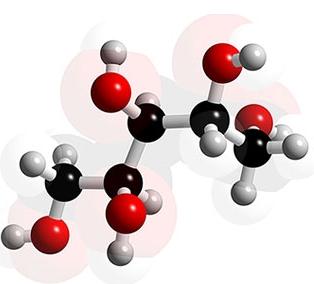
Las moléculas pueden ser desde muy pequeñas formadas por tan solo dos átomos (la más pequeña de todas es la molécula de hidrógeno, H2) hasta muy grandes y formadas por miles de átomos (tal como en el ADN, en las proteínas y en los polisacáridos).
Las moléculas y los compuestos iónicos
A pesar de que solemos representar a los compuestos iónicos tales como las sales y algunos óxidos con fórmulas similares a las que utilizamos para las moléculas, es muy importante aclarar que, en general, los compuestos iónicos no se consideran moléculas. Esto se debe a que un cristal de un compuesto iónico como el cloruro de sodio (NaCl o sal común de mesa) no está formado por unidades discretas en las que cada ion (por ejemplo, un catión sodio) está enlazado a un único contraión (por ejemplo, un anión cloruro) como pareciera sugerir su fórmula.
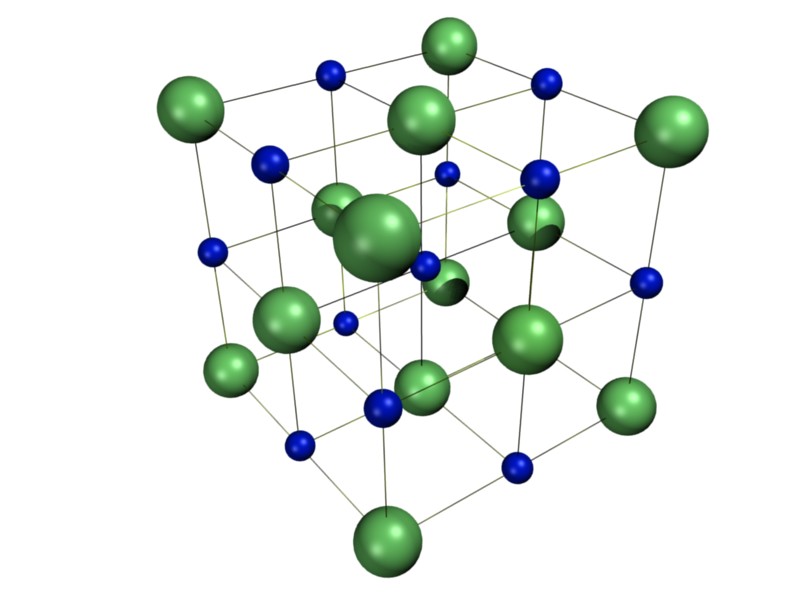
En el enlace iónico, los iones de cargas opuestas se unen entre sí por atracción electrostática, así que un único catión (ion con carga positiva) atrae igualmente a todos los aniones que tiene a su alrededor, los cuales tienen carga opuesta. Es como decir que cada catión está enlazado simultáneamente a todos los aniones que tiene a su alrededor en la estructura cristalina y, al mismo tiempo, cada anión está enlazado a todos los cationes que tiene alrededor suyo.
Por esta razón, un cristal iónico podría verse, en realidad, como un agregado de millones de iones, todos enlazados entre sí por medio de enlaces iónicos, y no como partículas discretas y separadas unas de otras formadas por grupos de átomos enlazados entre sí.
¿Por qué muchas personas se refieren a las sales como moléculas?
La confusión tal vez provenga del error muy común de referirse a las fórmulas con las que representamos a los compuestos iónicos (NaCl, KBr, NaNO3, por ejemplo) como fórmulas moleculares, cuando en realidad son fórmulas empíricas.
Lo mismo se puede decir de los pesos moleculares. Solo los compuestos y elementos moleculares (aquellos formados por moléculas) tienen peso molecular. Es incorrecto referirse al peso del NaCl como el peso molecular del cloruro de sodio (ya que el NaCl no es una molécula). En su lugar, debería llamársele peso fórmula, ya que no es más que el peso sumado de los átomos de la fórmula empírica.
Las moléculas y los sólidos de red covalente
Finalmente, cabe aclarar también que no todas las sustancias en las que los átomos están enlazados por medio de enlaces covalentes se consideran moléculas. Un ejemplo de esto son los sólidos covalentes (o sólidos de red covalente). Estas sustancias están conformadas por redes bidimensionales (láminas) o tridimensionales de átomos enlazados entre sí por medio de enlaces covalentes.
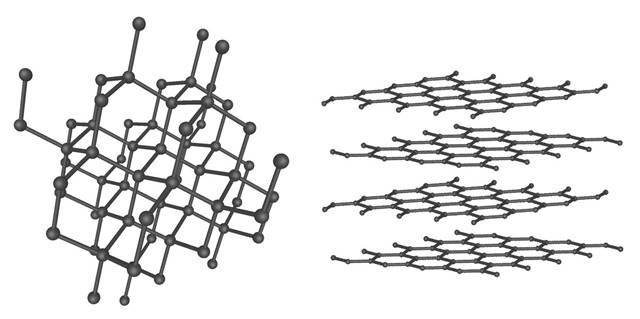
Con los sólidos de red covalente sucede lo mismo que con los sólidos iónicos: no existe una unidad discreta (que no sean átomos individuales) que pueda representar una molécula. Por esta razón, sustancias como el grafito y el diamante, que consisten en redes de átomos de carbono enlazados entre sí, no se consideran sustancias moleculares.
Tipos de moléculas
Las moléculas se pueden clasificar de varias maneras dependiendo de su composición, de su tamaño y de su origen:
Tipos de moléculas según su composición
- Moléculas homonucleares: son lasque están formadas por un solo tipo de átomos o, lo que es lo mismo, por átomos de un mismo elemento. Estas son las moléculas de las que están formados los elementos moleculares tales como el hidrógeno, el oxígeno y el nitrógeno molecular.
- Moléculas heteronucleares: son las más numerosas y están formadas por la unión de dos o más tipos de átomos. Esto quiere decir que representan las unidades discretas de los compuestos moleculares. Ejemplos incluyen el agua (H2O), el dióxido de carbono (CO2), el metano (CH4), entre otras.
Tipos de moléculas según su tamaño
- Moléculas diatómicas: son las formadas por solo dos átomos, sean estos iguales o diferentes entre sí.
- Moléculas triatómicas: son las formadas por tres átomos, sean estos iguales o diferentes entre sí, por ejemplo, el ozono, el agua y el dióxido de carbono.
- Moléculas poliatómicas pequeñas: están formadas por más de 3 átomos. No hay una frontera definida entre moléculas pequeñas y grandes, pero la mayoría de moléculas simples como la glucosa (C6H12O6), el metano (CH4) e incluso complejos más grandes de hasta cientos de átomos, aún se consideran moléculas pequeñas.
- Moléculas grandes o macromoléculas: el término macromolécula casi siempre se reserva para referirse a moléculas que contienen miles de átomos, y que además se forman por la unión de múltiples moléculas más pequeñas llamadas monómeros, una después de otra. Tal es el caso de los polímeros tanto naturales como sintéticos. Ejemplos incluyen el ADN, el ARN y las cadenas polipeptídicas de las proteínas.
Tipos de moléculas según su origen
- Moléculas orgánicas: estas son aquellas moléculas basadas en el carbono y que pueden contener también hidrógeno, oxígeno, nitrógeno, fósforo halógenos y azufre, ente otros, y que provienen de los seres vivos, tales como los hidrocarburos, los alcoholes y los compuestos aromáticos.
- Moléculas inorgánicas: Son lo contrario a las moléculas orgánicas. Tienen su origen en la atmósfera, en los suelos y en los cuerpos de agua, pero sin la intervención de los seres vivos.
- Moléculas de importancia biológica: dentro de las moléculas orgánicas, hay un grupo de moléculas que son particularmente importantes para la vida y los procesos celulares. Estas moléculas incluyen el agua, los carbohidratos, los aminoácidos y proteínas, los ácidos nucleicos y los lípidos, entre otras.
Tipos de moléculas según su polaridad
- Moléculas polares: son aquellas que tienen un momento dipolar neto, es decir que tienen enlaces polares cuyos momentos dipolares no se cancelan entre sí.
- Moléculas apolares: son moléculas que, o no tienen enlaces polares, o los momentos dipolares de todos sus enlaces se cancelan entre sí debido a la simetría molecular.
Ejemplos de moléculas grandes y pequeñas
El ozono (O3)
El ozono es un ejemplo de una molécula triatómica, homonuclear inorgánica.
El bucky ball o fulereno (C60)

El fulereno C60 es uno de los alótropos moleculares del carbono. Está formado por moléculas de 60 átomos de carbono que forman una esfera similar a un balón de fútbol, por lo que se trata de una molécula homonuclear.
El tetraóxido de dinitrógeno (N2O4)
Este gas color pardo está formado por moléculas de N2O4 las cuales son moléculas inorgánicas heteronucleares pequeñas.
Acetona ((CH3)2C=O)
La acetona es un ejemplo de una molécula orgánica polar.
Sacarosa (C12H22O11)
Este carbohidrato es un disacárido (formado por dos moléculas de azúcares enlazadas entre sí) y representa una molécula orgánica de importancia biológica.
Actina Globular (Actina G)
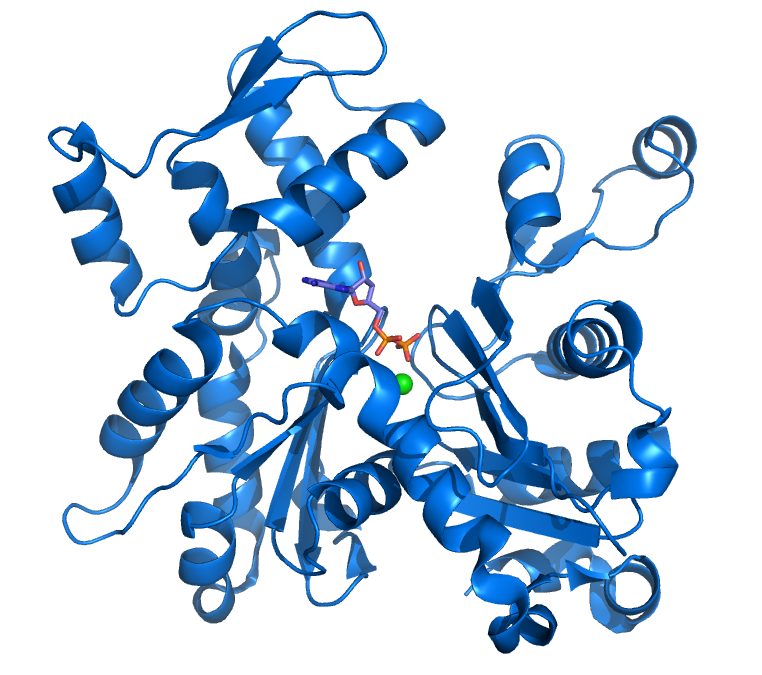
La actina globular es un ejemplo de una proteína, es decir, una macromolécula biológica, en este caso formada por la unión de 374 aminoácidos que forman una estructura globular.
Referencias
Brown, T. (2021). Química: La Ciencia Central. (11ra ed.). Londres, Inglaterra: Pearson Education.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
Flowers, P., Neth, E. J., Robinson, W. R., Theopold, K., & Langley, R. (2019). Chemistry: Atoms First 2e. Recuperado de https://openstax.org/books/chemistry-atoms-first-2e/pages/1-introduction



