Tabla de Contenidos
La Ley de Hess fue enunciada por el químico suizo Hermain Hess y destaca el hecho de que la entalpía es una función de estado. El enunciado de esta ley reza:
«El cambio de entalpía (ΔH) de una reacción química en la que un conjunto de reactivos se convierte en productos es el mismo independientemente de que el proceso se lleve a cabo en un solo paso o en una serie de pasos consecutivos».
Dicho de otra forma, el cambio de entalpía de una reacción es independiente del camino que lleva de los reactivos a los productos. Esto es consecuencia del hecho que la entalpía (H, no ΔH) es una función de estado. Esto quiere decir que su valor únicamente depende del estado actual de un sistema, y no de cómo el sistema llegó a él.
La Ley de Hess representa una de las leyes fundamentales de la termoquímica y permite el establecimiento de una escala relativa de medición de la entalpía de las distintas sustancias químicas a partir de ciertos estados de referencia, que corresponden a las sustancias elementales en sus estados naturales más estables en condiciones estándar, como se verá más adelante.
Explicación de la Ley de Hess
Como ΔH viene dado por la diferencia entre la entalpía de los productos y la de los reactivos, y cada una de estas entalpías solo dependerá del estado en el que se encuentran las respectivas sustancias químicas; entonces la diferencia entre ambas entalpías también será independiente de cómo se lleve a cabo la transformación.
Existen muchas analogías que permiten entender este concepto de forma sencilla. Un ejemplo es ver la entalpía de una sustancia como el balance en una cuenta de ahorros. Hay un balance (o una entalpía) en los reactivos, antes de que ocurra la reacción química, y habrá un balance después de ocurrida la reacción. La diferencia entre ambos balances es independiente de cuántos depósitos o retiradas de dinero se llevaron a cabo. Se pudo haber hecho un solo depósito, o se pudieron haber hecho múltiples depósitos y retiradas, pero una vez que se llega a los productos y se obtiene el balance final, este será el mismo sin importar cómo se llegó allí. Como en todos los casos se está partiendo del mismo estado inicial, el cambio de balance (ΔH) siempre será el mismo.
Aplicaciones de la Ley de Hess
La aplicación más importante de la Ley de Hess es que nos permite conocer las entalpías de reacción de prácticamente cualquier reacción de forma indirecta a través de la combinación de otras reacciones químicas más simples. Existen dos ejemplos particularmente importantes de esto:
Determinación de entalpías de reacción a partir de entalpías de formación
Todas las sustancias puras en la naturaleza están formadas por átomos de uno o más elementos químicos. Por ello, siempre podremos escribir una ecuación para la reacción en la que una sustancia pura se forma a partir de sus elementos en su estado natural más estable en condiciones estándar de temperatura y presión.
A este tipo de reacciones químicas se le denomina reacciones de formación. Algunos ejemplos de reacciones de formación son:
- Reacción de formación del agua líquida:
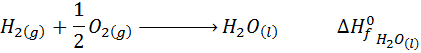
- Reacción de formación del ozono gaseoso:
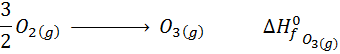
- Reacción de formación del óxido férrico:
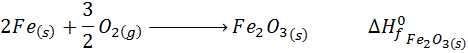
Debido a la forma en que se definen las reacciones de formación, cualquier otra reacción química imaginable puede escribirse como una combinación de reacciones de formación; algunas van en sentido directo y otras van en sentido inverso. Gracias a la Ley de Hess, podemos decir que el cambio de entalpía para transformar los reactivos de una reacción directamente en los productos en un solo paso, es igual a la entalpía de todas estas de reacciones de formación, lo que se resume en la siguiente ecuación:
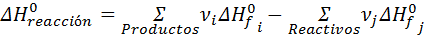
En esta ecuación, ν representa el coeficiente estequiométrico de la ecuación química ajustada.
Ciclo de Born-Haber de la energía reticular
El ciclo de Born-Haber es otro ejemplo típico de la aplicación de la Ley de Hess. En este caso se utilizan las entalpías de procesos como la fusión, la vaporización, la disociación de enlaces, así como otros calores de reacción tales como las entalpías de formación, las energías de ionización y las afinidades electrónicas para determinar la energía reticular de los compuestos iónicos. Esta corresponde a la entalpía del proceso mediante el cual un sólido iónico cristalino se separa en sus iones en estado gaseoso.
Gracias a la Ley de Hess, podemos determinar esta energía de forma indirecta, valiéndonos del hecho que el cambio de entalpía de la reacción directa en una sola etapa es igual a la suma de las entalpías de cualquier otro conjunto de reacciones que lleve desde el mismo estado inicial hasta el mismo estado final.
Referencias
Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry (Ed. rev.). Oxford, United Kingdom: Oxford University Press.
Chang, R. (2008). Fisicoquímica (3ra ed.). New York City, New York: McGraw Hill.
Chang, R., Manzo, Á. R., López, P. S., & Herranz, Z. R. (2020). Química (10ma ed.). New York City, NY: MCGRAW-HILL.
Suárez, T., Fontal, B., Meyes, M., Bellandi, F., Contreras, R., Romero, I. (2005). Principios de Termoquímica. Recuperado de http://www.saber.ula.ve/



