Tabla de Contenidos
Un enlace covalente múltiple consiste en un enlace químico en el que dos átomos comparten más de un par de electrones. El nombre se utiliza para distinguir este tipo de enlaces covalentes de los enlaces simples, en los que se comparte un solo par de electrones.
Los ejemplos más comunes de los enlaces múltiples son los enlaces dobles y los enlaces triples. Estos tipos de enlaces aparecen frecuentemente en muchos compuestos tanto orgánicos como inorgánicos.
En términos generales, los enlaces múltiples se caracterizan por ser más fuertes (sus energías de enlace son mayores) y más cortos que los enlaces simples entre los dos mismos elementos.
El enlace doble
El enlace doble es el primero de los enlaces múltiples. Se reconoce fácilmente ya que se representa con un par de líneas paralelas entre los dos átomos enlazados. Este tipo de enlaces se forma entre dos átomos que tengan hibridación sp2 (como en el caso de los alquenos), uno sp2 y el otro sp (como en el caso de los alenos y en el dióxido de carbono), o entre dos átomos con hibridación sp (como en el caso de los cumulenos).
Se llaman enlaces dobles ya que están compuestos por dos enlaces:
- Un enlace σ (letra griega sigma).
- Un enlace π (letra griega pi).
El enlace σ se forma por el solapamiento frontal entre orbitales atómicos híbridos (sp o sp2, por ejemplo). Por otro lado, el enlace π se forma por el solapamiento lateral de orbitales atómicos puros (no hibridizados) tales como los orbitales p o, en algunos casos, algunos orbitales d.
Los electrones que forman parte del enlace sigma se pueden conseguir, la mayor parte del tiempo, en el espacio que se encuentra entre los dos núcleos de los átomos enlazados. Los electrones del enlace π se encuentran en lóbulos a uno y otro lado de un plano que divide a la molécula a través del enlace, como se muestra en la siguiente figura.
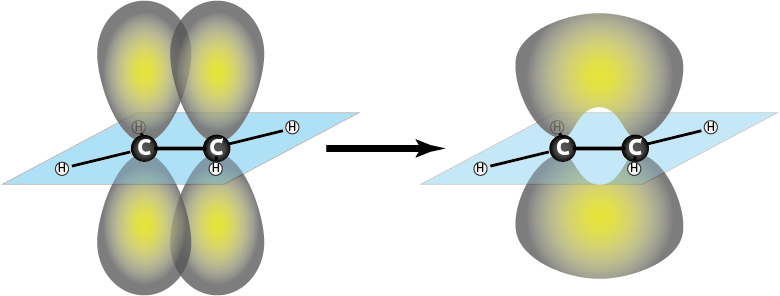
Una característica importante de los enlaces dobles es que son enlaces rígidos, lo que quiere decir que no permiten la rotación a lo largo del enlace. También son más fuertes y cortos que los enlaces simples.
Ejemplos de compuestos con enlaces dobles
Una gran variedad de compuestos orgánicos posee enlaces dobles (también llamados doble enlaces):
- Los alquenos poseen enlaces dobles carbono-carbono (C=C)
- Los aldehídos, cetonas, ácidos carboxílicos, ésteres, amidas, imidas y anhídridos todos contienen, como parte de su estructura, uno o más grupo carbonilo, el cual consiste en un átomo de carbono enlazado a un oxígeno por medio de un enlace doble.
- Las iminas poseen enlaces dobles C=N
- Como se mencionó antes, los alenos y los cumulenos poseen múltiples enlaces dobles C=C consecutivos.
El enlace triples
El enlace triple es un enlace covalente múltiple formado por 3 pares de electrones enlazantes. Se reconoce fácilmente ya que se representa por medio de tres líneas paralelas entre los dos átomos que une (C≡C, por ejemplo).
Este tipo de enlace covalente múltiple se forma entre átomos que poseen hibridación sp. Se llaman enlaces triples ya que están compuestos por tres enlaces:
- Un enlace σ.
- Dos enlaces π.
En este caso, el enlace σ se forma por el solapamiento frontal entre orbitales atómicos híbridos sp-sp, mientras que cada enlace π se forma por el solapamiento lateral de dos pares de orbitales atómicos puros p paralelos entre sí.
El enlace sigma del enlace triple es similar al del enlace doble, pero los dos enlaces π se fusionan en una sola región con forma aproximadamente tubular con los átomos enlazados en el centro, como se muestra en la siguiente figura.
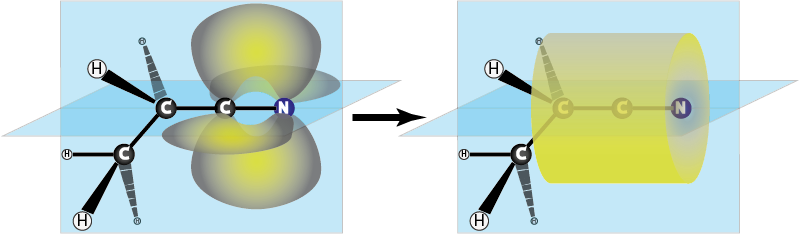
Comparados con los enlaces dobles, los enlaces triples son más fuertes y también son más cortos.
Ejemplos de compuestos con enlaces triples
El enlace triple es un enlace rico en electrones que se encuentra en los siguientes grupos funcionales orgánicos y moléculas inrogánicas:
- Los alquinos poseen enlaces triples carbono-carbono (C≡C)
- La molécula de nitrógeno (N2) y la molécula de monóxido de carbono poseen, respectivamente, enlaces triples :N≡N: y –:C≡O:+
- Los nitrilos poseen enlaces triples -C≡N:
- Las sales inorgánicas de cianuro y el ácido cianhídrico también contienen el mismo enlace –:C≡N:
- Otros elementos más pesados como el tungsteno también forman triples enlaces, tal como en el caso del hexa(terc-butoxi)ditungsteno (III)
Referencias
Carey, F. (1999). Quimica Organica (3ra ed.). Madrid, España: McGraw-Hill Companies.
Libretexts. (2021, 20 marzo). 3.2.2: Multiple Bonds. Recuperado de https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Map%3A_Inorganic_Chemistry_(Miessler_Fischer_Tarr)/03%3A_Simple_Bonding_Theory/3.02%3A_Valence_Shell_Electron-Pair_Repulsion/3.2.02%3A_Multiple_Bonds
Los enlaces múltiples. (2020, October 30). Recuperado de https://espanol.libretexts.org/@go/page/1864
March, Jerry (1985). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.). New York: Wiley. ISBN 0-471-85472-7.



