Tabla de Contenidos
Una celda electrolítica es un dispositivo electroquímico en el que se consume energía eléctrica para impulsar una reacción de óxido reducción o reacción redox no espontánea. Es lo opuesto a una celda galvánica o voltaica, la cual genera energía eléctrica a partir de una reacción redox espontánea.
Muchas de las reacciones no espontáneas que se llevan a cabo en las celdas electrolíticas implican la ruptura de un compuesto químico en sus elementos constituyentes o en sustancias químicas más simples. A esta clase de procesos de lisis o ruptura impulsados por energía eléctrica se le denomina electrólisis, que es de donde reciben su nombre las celdas electrolíticas.
Las celdas electrolíticas permiten convertir energía eléctrica en energía potencial química. También forman la base de muchos procesos metalúrgicos sin los cuales la sociedad como la conocemos hoy no existiría.
Celdas electrolíticas versus celdas electroquímicas
Un concepto relacionado con las celdas electrolíticas es el de celdas electroquímicas. Existe una pequeña división en torno al concepto estas últimas. Algunos autores consideran que todas las celdas en las que una reacción de óxido reducción esté asociada a una corriente eléctrica entre dos electrodos representa una celda electroquímica, sin importar si la reacción es espontánea o no. Visto desde ese punto de vista, las celdas electrolíticas vienen siendo un tipo particular de celda electroquímica.
Por otro lado, otro grupo de autores define a las celdas electroquímicas como aquellas en las que una reacción de óxido reducción espontánea genera una corriente eléctrica. En este caso, las celdas electrolíticas vendrían siendo justo lo contrario de las celdas electroquímicas.
Independientemente de esta disyuntiva, está claro que lo que caracteriza a una celda electrolítica es que involucra una reacción redox que no es espontánea, y que, por lo tanto, requiere de un aporte de energía de una fuente externa para poder ocurrir.
Celdas, semiceldas y semirreacciones
Como su nombre lo indica, toda reacción de óxido reducción involucra dos procesos separados pero interrelacionados que son la oxidación y la reducción. La oxidación consiste en la pérdida de electrones mientras que la reducción consiste en la ganancia de los mismos. Como en una reacción química neta no pueden quedar electrones huérfanos sin un átomo donde vivir, la oxidación y la reducción no pueden ocurrir la una sin la otra. Sin embargo, no es obligatorio que ambos procesos ocurran en el mismo sitio.
Este último hecho representa la razón de ser de las celdas electroquímicas y también (o por extensión), de las celdas electrolíticas. Una celda electrolítica no es más que un dispositivo experimental en el cual se separan físicamente los procesos de oxidación y de reducción de una reacción redox, pero que permite el flujo de electrones desde donde ocurre la oxidación hasta donde ocurre la reducción a través de un conductor eléctrico. A los compartimientos separados donde se llevan a cabo estas semirreacciones se les denomina semiceldas, y el lugar o superficie específica donde ocurre cada semirreacción se denomina electrodo.
Toda celda electroquímica o electrolítica está definida por las características de los electrodos, por la semirreacción particular que ocurre en cada uno de ellos y por la composición y concentración de las soluciones presentes en cada semicelda. Además, la espontaneidad de la reacción de óxido reducción viene determinada por el llamado potencial de celda (representado como Ecelda).
Un potencial de celda positivo implica una reacción espontánea, mientras que si es negativo, la reacción no será espontánea. Por lo tanto, podemos definir nuevamente a una celda electrolítica como aquella que posee un potencial de celda negativo, por lo que requiere de energía eléctrica para poder funcionar.
Funcionamiento de las celdas electrolíticas
La siguiente figura muestra los componentes de una celda electrolítica genérica típica.

Como se puede observar, la celda está compuesta por dos electrodos (el ánodo y el cátodo) que están sumergidos en una solución de un electrolito (lo que asegura que conduzca la electricidad, cerrando el circuito eléctrico) y que están, además, conectados por medio de conductores eléctricos que pasan por una fuente de corriente directa (la caja gris que está conectada a la electricidad de la pared).
En la parte derecha de la imagen se muestran las semirreacciones que ocurren en esta celda electrolítica genérica. Como se puede ver, el potencial de celda (el de la reacción global) es negativo, por lo que los electrones (que también son negativos) no tienen la tendencia a fluir desde el ánodo hacia el cátodo.
Sin embargo, al encender la fuente de poder, esta genera una diferencia de potencial que contrarresta y supera el potencial de celda, lo que impulsa a los electrones a moverse a través del conductor, haciendo que ocurra la reacción de óxido reducción.
Por definición, en una celda electrolítica el ánodo es el electrodo donde ocurre la oxidación y se suele representar a la izquierda. En cambio, el cátodo es donde ocurre la reducción y se representa a la derecha, por lo que los electrones siempre fluyen del ánodo al cátodo.
Una manera sencilla de recordar esto (en español) es que “las vocales van con las vocales y las consonantes con las consonantes”:
Ánodo, Oxidación e Izquierda comienzan con vocal, así que van todos juntos; mientras, Cátodo, Reducción y Derecha comienzan todos con consonante, por lo que también van juntos.
Usos de celdas electrolíticas
Se podría decir que las celdas electrolíticas son esenciales para nuestra forma de vida moderna. Esto se debe, en primer lugar, a las numerosas industrias esenciales que dependen enteramente de procesos electrolíticos, y, en segundo lugar, al hecho de que forman la base de nuestra capacidad de almacenar energía eléctrica en forma de energía potencial química. Algunos de las aplicaciones más importantes de las celdas electrolíticas son:
Producción y purificación de metales
Algunos de los metales más importantes para el ser humano como el aluminio y el cobre se producen industrialmente por medio de celdas electrolíticas. También representan una de las pocas formas para la obtención de metales activos como los metales alcalinos (litio, sodio y potasio) y algunos alcalinotérreos de gran importancia como el magnesio.
Producción de halógenos
Los halógenos como el flúor y el cloro son de gran importancia en la industria química. Son reactivos indispensables para la producción de muchos derivados del petróleo tal como el PVC y el teflón, además de utilizarse en un sinfín de procesos sintéticos para fármacos que salvan vidas todos los días. La principal fuente de estos halógenos es la electrólisis de sales que contienen sus iones.
Almacenamiento de energía
Como se mencionó anteriormente, las celdas electrolíticas son capaces de almacenar energía eléctrica en forma de energía química. El ejemplo más palpable de esto es el proceso de carga de todas las baterías recargables. Sin las celdas electrolíticas, las baterías de litio que proporcionan energía a la gran mayoría de los dispositivos móviles que utilizamos diariamente no serían recargables. La electrólisis del agua es la base para la producción de hidrógeno gaseoso, el cual puede utilizarse como combustible limpio en un cohete como, por ejemplo, el Blue Shephard de Blue Origin, la empresa aeroespacial de Jeff Bezos, o como fuente de energía eléctrica en las celdas de combustible de algunos modelos de automóviles eléctricos.
Ejemplos de celdas electrolíticas
Electrólisis del agua
La electrólosis del agua se lleva a cabo haciendo pasar una corriente a través de una solución de ácido sulfúrico 0,1 M. Las semirreacciones involucradas y la reacción global son:
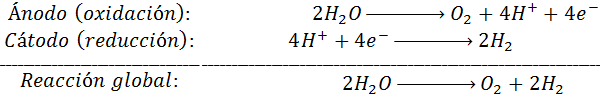
Electrólisis del cloruro de sodio fundido
En el cloruro de sodio fundido los iones actúan como los portadores de carga que conduce la electricidad. Así se produce el sodio a nivel industrial.

Referencias
- Halógenos (s.f.). Revisado en julio del 2021 en https://www.textoscientificos.com/quimica/inorganica/halogenos/fluor
- Electrochemical cells (s.f.). Revisado en julio del 2021 en https://courses.lumenlearning.com/boundless-chemistry/chapter/electrochemical-cells/
- Electrochemical Cells. (2020, August 14). Revisado en julio del 2021 en https://chem.libretexts.org/@go/page/41636
- http://depa.fquim.unam.mx/amyd/archivero/INTRODUCCIONALAELECTROQUIMICA_22641.pdf
- Electrochemical Cell Conventions. (2021, April 10). Revisado en julio del 2021 en https://chem.libretexts.org/@go/page/291



