Tabla de Contenidos
En este artículo se muestra la solución de cuatro clases de problemas típicos de calorimetría y termodinámica relacionados con el cálculo de la temperatura final de un sistema tras llevarse a cabo una trasferencia de calor.
- El primer caso consiste en el cálculo de la temperatura final de un sistema, dados la capacidad calorífica del mismo y la cantidad de calor absorbido.
- El segundo es similar al primero, con la diferencia de que el sistema está formado por un gas ideal y no se proporciona la capacidad calorífica.
- El tercer caso combina los principios de termoquímica con el proceso aprendido en el caso 1. Este problema tiene que ver con el cálculo de la temperatura final de un calorímetro de capacidad calorífica total conocida, dentro del cual se lleva a cabo la combustión total de una cantidad conocida de un compuesto orgánico.
- Finalmente, el cuarto caso es un ejemplo del cálculo de la temperatura final o de equilibrio después de la transferencia de calor entre dos cuerpos que se encuentran inicialmente a temperaturas diferentes.
En todos los casos, el cálculo se basa en la fórmula que define a la cantidad de calor:
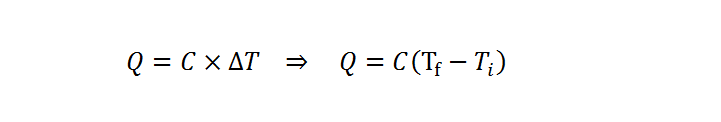
Donde Q representa la cantidad de calor transferido, C es la capacidad calorífica del sistema (también llamada capacidad calórica) y DT se refiere al cambio de temperatura o, lo que es lo mismo, la diferencia entre las temperaturas final e inicial.
También se utilizarán las fórmulas de la capacidad calorífica en términos de la masa y el calor específico, así como de los moles y la capacidad calorífica molar.
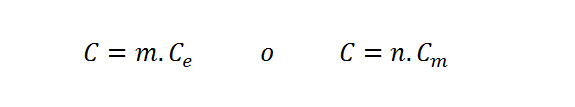
En estas ecuaciones m representa la masa, Ce el calor específico, n el número de moles y Cm la capacidad calorífica molar.
Por convención, se considera que el calor es positivo cuando entra al sistema (causando un aumento en la temperatura) y negativo cuando sale del mismo (causando una disminución en la temperatura).
Caso 1: Cálculo de la temperatura final de un cuerpo tras absorber una cantidad conocida de calor.
Enunciado
Determine la temperatura final de un bloque de cobre que tiene una capacidad calorífica total de 230 cal/°C y se encuentra inicialmente a 25,00 °C si absorbe 7.850 calorías en forma de calor desde los alrededores.
Solución
En este caso, los datos disponibles son la temperatura inicial, la capacidad calorífica y la cantidad de calor. Además, en vista de que el enunciado especifica que el bloque de cobre absorbe el calor, entonces se sabe que el signo del calor es positivo (+). En resumen:
Q = + 7.850 cal
C = 230,0 cal/°C
Ti = 25,00°C
Tf = ?
Ahora que tenemos los datos ordenados, es fácil ver que todo lo que hay que hacer es resolver la segunda ecuación de calor para obtener la temperatura final, Tf. Esto se logra dividiendo en primer lugar ambos miembros entre la capacidad calorífica y luego sumando la temperatura inicial a ambos miembros:
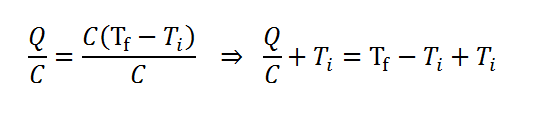
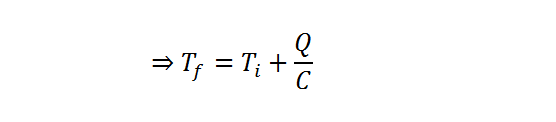
Ahora se sustituyen los datos en la ecuación, se calcula y listo:
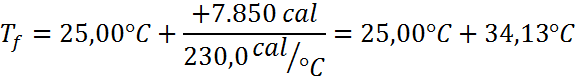
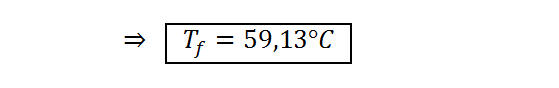
Respuesta
Luego de absorber 7.850 calorías de calor, el bloque de cobre se calienta desde 25,00 °C hasta 59,13 °C.
Caso 2: Cálculo de la temperatura final de un gas ideal después de perder calor.
Enunciado
Determine la temperatura final de una muestra de aire que se encuentra inicialmente a una temperatura de 180,0 °C ocupando un volumen de 500,0 L a una presión de 0,500 atm si pierde 20.021 Jouls de calor manteniendo el volumen constante. Considere el aire como un gas ideal diatómico para el cual la capacidad calorífica molar tiene un valor de 20,79 J/mol.K.
Solución
Al igual que antes, se comienza extrayendo los datos del enunciado. Lo más importantes en este caso es recordar que, por convención, el calor que sale del sistema es negativo, así que es esencial tener cuidado en no olvidar el signo. Además, hay que tener cuidado con las unidades, ya que en este caso el calor está dado en Jouls y no en calorías.
También se debe transformar la temperatura a Kelvin para poder utilizar la ley de los gases ideales.
Ti = 180,0°C + 273.15 = 453,15 K
Cm = 20,79 J/mol.K
V = 500,0 L
P = 0,500 atm
Q = – 20.021 J
Tf = ?
Dos detalles adicionales son de gran importancia en este problema. El primero es el hecho de que se puede considerar al aire como un gas ideal, lo que implica que se puede utilizar la ley de los gases ideales. De esta ecuación (la cual se presenta abajo), se conoce todo a excepción del número de moles, por lo que se puede utilizar para calcularlos.
Comenzamos resolviendo la ley de los gases ideales para hallar el número de moles de aire presentes en el sistema:
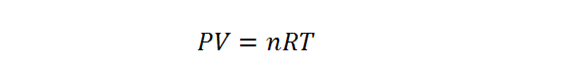
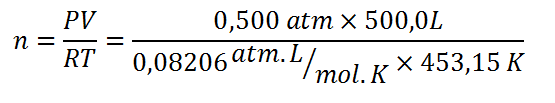
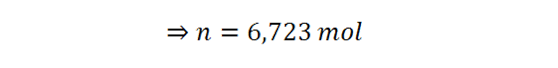
Ahora se pueden tomar dos caminos diferentes. Es posible utilizar los moles y la capacidad calorífica molar para determinar la capacidad calorífica del sistema y luego utilizarla para calcular la temperatura final, o se puede combinar ambas ecuaciones en una sola y resolver luego para Tf.
Aquí haremos lo segundo. Primero sustituimos C = n.Cm en la ecuación del calor:
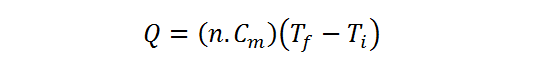
Ahora se divide todo entre n.Cm y se suma la temperatura inicial en ambos miembros, como hicimos antes:
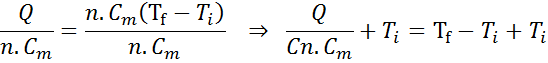
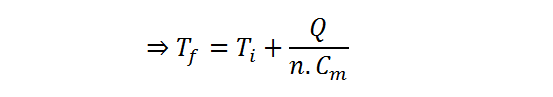
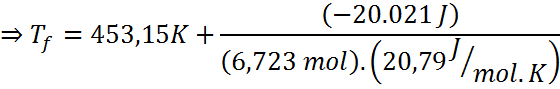
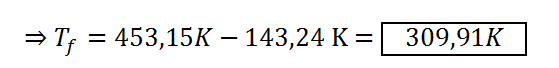
Respuesta
La muestra de aire se enfría hasta una temperatura de 309,91 K, lo que equivale a 36,76 °C luego de perder 20.021 J de calor.
Caso 3: Cálculo de la temperatura final de un calorímetro tras una reacción exotérmica.
Enunciado
En un calorímetro a presión constante que posee una capacidad calorífica total de 4.020 cal/°C y que se encuentra originalmente a 25 °C se quema una muestra de 0,0500 mol de ácido benzoico, el cual posee una entalpia de combustión de – 3.227 kJ/mol. Determine la temperatura final del sistema al alcanzarse el equilibrio térmico.
Solución
n = 0,0500 mol de ácido benzoico
∆Hc = – 3.227 kJ/mol
C = 4.020 cal/°C
Ti = 25,00 °C
Tf = ?
En este caso, el calor proviene de la combustión del ácido benzoico. Este es un proceso exotérmico (que libera calor) debido a que la entalpía es negativa. Sin embargo, en vista de que la combustión ocurre dentro del calorímetro, todo el calor liberado por la reacción es absorbido por el calorímetro. Esto significa que:
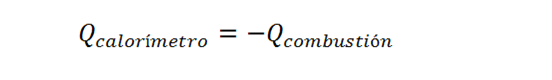
Donde el signo menos refleja el hecho de que la reacción libera mientras que el sistema (el calorímetro) absorbe calor, por lo que ambos calores deben poseer signos opuestos.
Además, el calor liberado por le reacción de 0,500 mol del ácido debe ser el producto del número de moles por la entalpía de combustión molar:
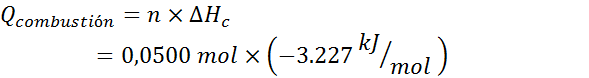
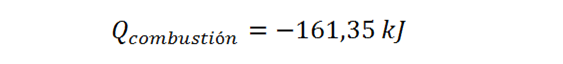
Por lo tanto, el calor absorbido por el calorímetro será:
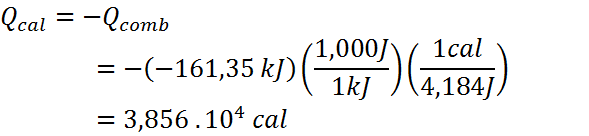
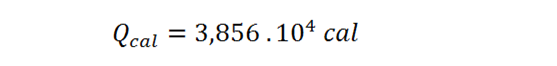
Ahora, se utiliza la misma ecuación para la temperatura final del primer ejemplo:
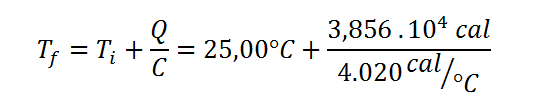
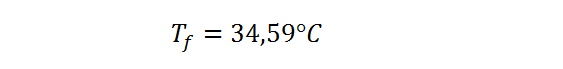
Respuesta
La temperatura del calorímetro aumenta desde 25,00 °C hasta 34,59 °C después de la combustión de la muestra del ácido benzoico.
Caso 4: Cálculo de la temperatura final de equilibrio por transferencia de calor entre cuerpos a temperaturas iniciales diferentes.
Enunciado
En un recipiente con paredes adiabáticas (que no conducen el calor) que contiene 250 g de agua inicialmente a 15 °C se introduce una pieza caliente de hierro de 100 g que está inicialmente a 95 °C. El calor específico del hierro es de 0,113cal/g.°C.
Solución
En este caso hay dos sistemas que están experimentando transferencia de calor: el agua que está en el recipiente y la pieza de hierro. Se debe recordar que el calor específico del agua es de 1 cal/g.°C. Por esta razón, los datos se deben separar por sistema:
| Datos del agua | Datos del hierro |
| Ce, agua = 1 cal/g.°C | Ce, hierro = 1 cal/g.°C |
| magua = 250 g | mhierro = 100 g |
| Ti, agua = 15,00°C | Ti, hierro = 95,00°C |
| Tf, agua = ? | Tf, hierro = ? |
Tanto para el agua como para el hierro se pueden escribir ecuaciones del calor:
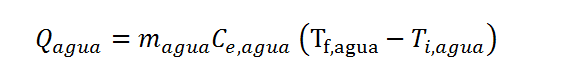
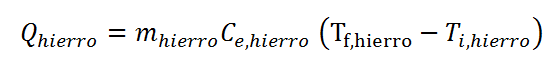
Donde se sustituyó la capacidad calorífica de cada sistema por el producto entre su masa y su calor específico. Estas ecuaciones tienen demasiadas incógnitas ya que no conocemos ninguno de los dos calores, ni tampoco ninguna de las dos temperaturas finales.
Como tenemos dos ecuaciones y cuatro incógnitas, necesitamos dos ecuaciones independientes adicionales para poder resolver el problema. Estas dos ecuaciones consisten en la relación entre los dos calores y entre las dos temperaturas finales.
Como el calor fluye de uno de los sistemas al otro y asumimos que nada se pierde a los alrededores (porque las paredes son adiabáticas) entonces todo el calor que libera el bloque de hierro lo absorbe el agua. Por lo tanto:
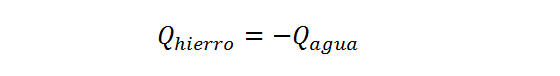
Donde, nuevamente, se coloca el signo negativo para resaltar el hecho de que uno libera calor mientras que el otro lo absorbe. Este signo no indica que el calor del agua sea negativo (de hecho, debe ser positivo, ya que el agua es la que absorbe calor), sino que indica que el signo del calor del hierro es el opuesto al del agua. Como el calor del agua es positivo, entonces la ecuación anterior asegura que el calor del hierro sea negativo, como se supone que debe ser.
La otra ecuación relaciona las temperaturas finales. Siempre que dos cuerpos estén en contacto térmico, el que esté a mayor temperatura transferirá calor al más frío hasta que se alcance el equilibrio térmico. Esto ocurre cuando ambas temperaturas son exactamente iguales. Por lo tanto, la temperatura final de ambos sistemas debe ser la misma:
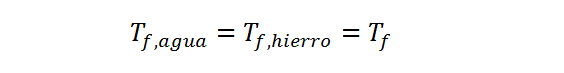
Reemplazando las dos primeras ecuaciones en la segunda, y sustituyendo ambas temperaturas finales por Tf, se obtiene:
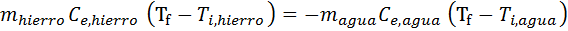
En esta ecuación la única incógnita es Tf, así que todo lo que falta hacer es resolverla para hallar dicha variable. En primer lugar resolvemos la distributiva en ambos paréntesis, luego agrupamos términos del mismo lado y finalmente sacamos el factor común:
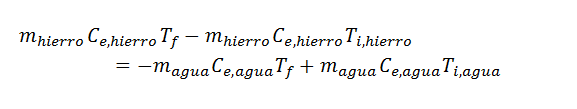
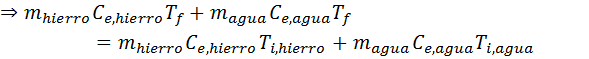
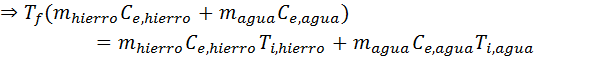
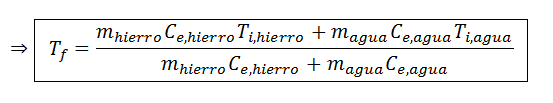
Ahora sustituimos los datos y ¡listo!
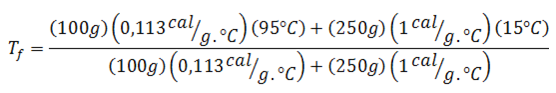
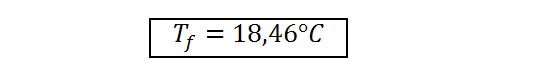
Respuesta
La temperatura de equilibrio del sistema formado por 250g de agua y 100 g de hierro es de 18,46°C.
Consejos y recomendaciones
Un punto importante al tener en cuenta al llevar a cabo estos cálculos es que el resultado siempre debe tener sentido. Si ponemos en contacto térmico a dos cuerpos que están a temperaturas distintas, lo lógico es que la temperatura final esté entre ambas temperaturas iniciales (en este caso en algún lugar entre 15°C y 95°C).
Si el resultado da por encima de la temperatura mayor o por debajo de la temperatura menor, obligatoriamente debe haber un error en los cálculos o en el procedimiento. El error más común es olvidar colocar el signo menos en la igualdad de los dos calores.
Otro detalle a tomar en cuenta es que la temperatura final siempre será más cercana a la temperatura inicial del cuerpo con la mayor capacidad calorífica. En este caso, la capacidad calorífica del agua es de 250 x 1 = 250 cal/°C, mientras que la del hierro es 100 x 0,113 = 11,3 cal/°C. Como se puede ver, la del agua es más de 20 veces superior que la del hierro, por lo que tiene sentido que la temperatura final esté mucho más cerca de 15°C, que es la temperatura inicial del agua, que de 95°C que es la del hierro.
Referencias
- Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry (Ed. rev.). Oxford, United Kingdom: Oxford University Press.
- Britannica, T. Editors of Encyclopaedia (2018, December 28). Heat capacity. Encyclopedia Britannica. https://www.britannica.com/science/heat-capacity
- Britannica, T. Editors of Encyclopaedia (2021, May 6). Specific heat. Encyclopedia Britannica. https://www.britannica.com/science/specific-heat
- Cedrón J.; Landa V.; Robles J. (2011). 1.3.1.- Calor Específico y Capacidad Calorífica | Química general. Recuperado 24 de julio de 2021, de http://corinto.pucp.edu.pe/quimicageneral/contenido/131-calor-especifico-y-capacidad-calorifica.html
- Chang, R. (2008). Fisicoquímica (3ra ed.). New York City, New York: McGraw Hill.
- Química.es. (s. f.). Calor específico. Recuperado 24 de julio de 2021, de https://www.quimica.es/enciclopedia/Calor_espec%C3%ADfico.html
- Wunderlich, B. (2001). Thermal Analysis. Encyclopedia of Materials: Science and Technology, 9134–9141. https://doi.org/10.1016/b0-08-043152-6/01648-x



