Tabla de Contenidos
¿Qué es el punto de congelación?
El punto de congelación o punto de solidificación de un líquido corresponde a la temperatura característica a una presión dada, a la cual dicho líquido pasa al estado sólido. En otras palabras, es la temperatura a la cual ocurre el proceso de solidificación o congelación de un líquido como el agua.
En principio, este cambio de fase es un cambio reversible que puede alcanzas el equilibrio con el proceso inverso, el cual se denomina fusión. Por ejemplo, en el caso del agua:
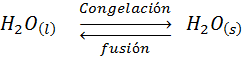
Por esta razón, también se puede definir el punto de congelación del agua, como la temperatura a la cual se establece el equilibrio de fases entre el agua sólida y líquida a la presión a la que se encuentre el sistema.
Como existe un equilibrio entre la fusión y la solidificación, entonces el punto de congelación resulta ser el mismo que el punto de fusión.
Punto de congelación versus punto de congelación normal del agua
Se debe aclarar que el punto de congelación de cualquier sustancia no es una cantidad fija, ya que depende de la presión a la que se encuentre el sistema. Esto significa que el agua, por ejemplo, no se derretirá a la misma temperatura al nivel del mar, dónde la presión es de alrededor de 1 atm, que en una montaña a 2,000 m.s.n.m., donde la presión es menor que 0,8 atm.
Lo mismo se puede decir acerca de los demás cambios de fase, y el efecto es incluso peor para el punto de ebullición que para el mismo punto de congelación.
Sin embargo, cabe preguntarse, entonces ¿Por qué se habla de “el punto de congelación” como si fuera uno solo? La razón es muy sencilla. Para evitar confusiones, se estableció el concepto de punto de congelación o fusión normal, el cual corresponde al punto de congelación a una presión de exactamente 1 atm. Este punto de congelación sí es único y característico de cada sustancia pura. Existe un concepto equivalente para el punto de ebullición y el de sublimación.
Así que, cuando hablamos del punto de congelación del agua, casi siempre nos referimos, en realidad, al punto de congelación normal.
¿Cuál es el punto de congelación o de fusión del agua?
El punto de congelación del agua a la presión normal de 1 atmósfera (es decir, el punto de congelación normal del agua) es justamente la temperatura de referencia de la escala de temperatura Celsius, y, por lo tanto, vale 0°C. Por otro lado, cuando Fahrenheit estableció la escala de temperatura que lleva su nombre, fijó como punto de referencia la menor temperatura que podía registrar, a la cual le asignó el valor de 0°F, y luego le asignó al punto de fusión o de congelación del agua una temperatura de 32°F.
Además de estas dos populares unidades de temperatura, también existen otras dos que son igualmente importantes, que son la escala de temperatura absoluta Kelvin y la escala Rankine. En la siguiente tabla se presenta el punto de congelación del agua en las cuatro escalas de temperatura mencionadas:
| Escala | Punto de congelación del agua |
| Celsius (°C) | 0°C |
| Kelvin (K) | 273.15 K |
| Fahrenheit (°F) | 32°F |
| Rankine (°R) | 491,67°R |
Factores que afectan el punto de congelación del agua
La presión
Ya vimos que la presión puede afectar el punto de congelación del agua. En este caso, a mayor presión, menor es el punto de congelación ya que el agua líquida es más densa que el hielo. Con otras sustancias sucede lo contrario. Sin embargo, el efecto en general es bastante pequeño.
Para observar el efecto de la presión sobre el punto de congelación del agua, este se presenta en la siguiente tabla a varias presiones diferentes.
| Presión (atm) | Tf (°C) | Tf (°F) | Tf (K) | Tf (°R) |
| 0,01 | 0 | 32 | 273,20 | 491,70 |
| 0,1 | 0 | 32 | 273,20 | 491,70 |
| 1 | 0 | 32 | 273,15 | 491,67 |
| 10 | -0,1 | 31,9 | 273,10 | 491,60 |
| 100 | -0,8 | 30,6 | 272,40 | 490,30 |
Los solutos o impurezas
Además de la presión, el punto de congelación del agua puede variar debido a la presencia de impurezas o solutos disueltos en ella. Esto es consecuencia de una propiedad coligativa de las soluciones denominada “descenso del punto de congelación”. A mayor concentración total de solutos (o impurezas), menor es el punto de congelación del agua. Esta propiedad se utiliza para derretir el hielo en las calles luego de una nevada y para evitar que el agua líquida se congele dentro de los motores durante el invierno.
En la siguiente tabla se muestra el punto de congelación o fusión del agua a una presión de 1 atmósfera pero a diferentes concentraciones de sal común (NaCl):
| Concentración de NaCl (%m/m) | Tf (°C) | Tf (°F) | Tf (K) | Tf (°R) |
| 0 | 0 | 32 | 273,15 | 491,67 |
| 0.5 | -0,3 | 31,46 | 272,85 | 491,13 |
| 1 | -0,59 | 30,94 | 272,56 | 490,61 |
| 2 | -1,19 | 29,86 | 271,96 | 489,53 |
| 3 | -1,79 | 28,78 | 271,36 | 488,45 |
| 4 | -2,41 | 27,66 | 270,74 | 487,33 |
| 5 | -3,05 | 26,51 | 270,1 | 486,18 |
| 6 | -3,7 | 25,34 | 269,45 | 485,01 |
| 7 | -4,38 | 24,12 | 268,77 | 483,79 |
| 8 | -5,08 | 22,86 | 268,07 | 482,53 |
| 9 | -5,81 | 21,54 | 267,34 | 481,21 |
| 10 | -6,56 | 20,19 | 266,59 | 479,86 |
| 12 | -8,18 | 17,28 | 264,97 | 476,95 |
| 14 | -9,94 | 14,11 | 263,21 | 473,78 |
| 16 | -11,89 | 10,6 | 261,26 | 470,27 |
| 18 | -14,04 | 6,73 | 259,11 | 466,4 |
| 20 | -16,46 | 2,37 | 256,69 | 462,04 |
| 26 | -19,18 | -2,52 | 253,97 | 457,15 |
Como se puede observar, la concentración de sal puede afectar fuertemente el punto de congelación del agua, y reducirlo en 20°C o incluso más.
Referencias
Chang, R. (2008). Fisicoquímica (1.a ed.). New York City, New York: McGraw Hill.
Engineering Toolbox. (s. f.). Ice / Water – Melting Points at Higher Pressure. Recuperado 15 de junio de 2021, de https://www.engineeringtoolbox.com/water-melting-temperature-point-pressure-d_2005.html?vA=40&units=B#
Las propiedades coligativas. (2020, October 30). Retrieved June 29, 2021, from https://espanol.libretexts.org/@go/page/1889



